
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 该反应中Na2O2仅作氧化剂 | |
| C. | 4molNa2O2在反应中共得到8NA个电子 | |
| D. | Fe(OH)3是氧化产物,每生成1molO2反应过程中共转移6mol电子 |
分析 A、元素化合价升高的物质做还原剂被氧化,得到氧化产物,发生氧化反应;
B、过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂;
C、还原剂被氧化得到氧化产物,4mol过氧化钠有1mol做还原剂,3mol做氧化剂;
D、过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂,反应得到电子6mol电子;
解答 解:A、该反应中Fe2+是还原剂,O2是氧化产物,故A错误;
B、4mol过氧化钠有1mol做还原剂,3mol做氧化剂,故B错误;
C、过氧化钠中氧元素化合价从-1价升高到0价,降低到-2价,4mol过氧化钠有1mol做还原剂,3mol做氧化剂,反应得到电子8NA个电子,故C错误;
D、Fe(OH)3是氧化产物,4mol过氧化钠有1mol做还原剂,3mol做氧化剂,每生成1 mol O2反应过程中共转移6 mol电子,故D正确;
故选D.
点评 本题考查了氧化还原反应的概念判断,电子转移的计算应用,关键是分析元素化合价变化的特征判断氧化还原反应的概念方法,是复杂的氧化还原反应,难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | (3)用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | 溶液PH=8 | (4)S2O32-+H2O?HS2O3-+OH- |
| 探究② | 向新制氯水(PH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)Na2S2O3具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
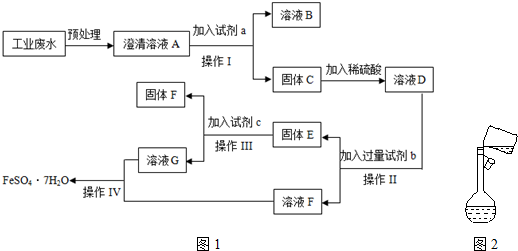
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SO32-、Cl-、NO3- | B. | H+、NH4-、Al3+、SO42- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、Ca2+、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na在常温下,与空气中的氧气不反应,所以Na不活泼 | |
| B. | Na在空气中燃烧,发出黄色火焰,产物是Na2O | |
| C. | Na是银白色金属,硬度大、熔点高 | |
| D. | Na应保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:1 | C. | 1:3:2 | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com