
分析 由焰色反应为黄色,且A、C、D均与盐酸反应生成E,知E为NaCl,无色无味气体H能使澄清石灰水变浑浊,则H为CO2,C、D还生成气体H使澄清石灰水变浑浊,知C、D为Na2CO3或NaHCO3,F和H(CO2)也可反应生成C和另一种无色无味气体B,则F为Na2O2、B为O2、C为Na2CO3,因而D为NaHCO3,D和A反应可生成C(Na2CO3),则A为NaOH,以此解答该题.
解答 解:由焰色反应为黄色,且A、C、D均与盐酸反应生成E,知E为NaCl,无色无味气体H能使澄清石灰水变浑浊,则H为CO2,C、D还生成气体H使澄清石灰水变浑浊,知C、D为Na2CO3或NaHCO3,F和H(CO2)也可反应生成C和另一种无色无味气体B,则F为Na2O2、B为O2、C为Na2CO3,因而D为NaHCO3,D和A反应可生成C(Na2CO3),则A为NaOH,
(1)由以上分析可知A为NaOH,B为O2,C为Na2CO3,E为NaCl,F为Na2O2,
故答案为:NaOH;O2;Na2CO3;NaCl;Na2O2;
(2)①D为NaHCO3,与盐酸反应的离子方程式为HCO3-+H+=CO2↑+H2O,
故答案为:HCO3-+H+═H2O+CO2↑;
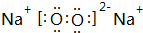
②F为Na2O2,可与水反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O=Na++OH-+O2↑,
故答案为:2Na2O2+2H2O=Na++OH-+O2↑.
点评 本题考查无机物的推断,侧重于考查学生的综合分析能力,不但要求同学们具备有关物质的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断,题目难度不大.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
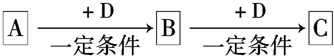
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y、W的最高价含氧酸酸性顺序:Y>W>X | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | X、W形成的化合物XW4属于离子化合物 | |
| D. | 原子半径:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 该反应中Na2O2仅作氧化剂 | |
| C. | 4molNa2O2在反应中共得到8NA个电子 | |
| D. | Fe(OH)3是氧化产物,每生成1molO2反应过程中共转移6mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+2H2O═4HF+O2 | D. | Na2O+2H2O═2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com