

| 开始沉淀pH | 完全沉淀pH | |
| Fe(OH)2 | 6.5 | 9.7 |
| Fe(OH)3 | 2.5 | 3.7 |
分析 废钒催化剂加入亚硫酸钠、稀硫酸浸泡,然后过滤得到滤渣和滤液,滤液中含有VO2+和Fe2+,向滤液中加入氯酸钾并调节溶液pH,氯酸钾具有强氧化性,能将VO2+氧化生成V2O5沉淀,氯酸钾将亚铁离子氧化生成铁离子,然后过滤得到滤液,滤液中含有氯酸钾、铁离子、HCl等,将滤渣用NaOH溶液溶解并过滤得到滤渣和含有VO3-溶液,向滤液中加入稀硫酸、硫酸铵,得到滤渣和固体NH4VO3,将NH4VO3焙烧得到V2O5和氨气,
(1)反应物的接触面积越大,反应速率越快;
(2)步骤②中VO2+和C1O3-发生氧化还原反应,Cl元素化合价由+5价变为-1价,所以氯酸根离子作氧化剂,则VO2+作还原剂,化合价由+4价变为+5价;
(3)步骤②得到铁离子,调节溶液的pH使V2O5沉淀但不能使铁离子产生沉淀;
(4)V2O5和NaOH溶液发生复分解反应生成NaVO3;
(5)硫酸铵溶液呈酸性,步骤④中需加人硫酸,抑制铵根离子水解;
(6)焙烧产生的气体是气体,用稀硫酸吸收得到硫酸铵;
(7)V2O5可制成某电池的电解液.该电池的总反应为:VO2++2H++V2+?V3+VO2++H2O,放电时的负极上V2+失电子发生氧化反应.
解答 解:废钒催化剂加入亚硫酸钠、稀硫酸浸泡,然后过滤得到滤渣和滤液,滤液中含有VO2+和Fe2+,向滤液中加入氯酸钾并调节溶液pH,氯酸钾具有强氧化性,能将VO2+氧化生成V2O5沉淀,氯酸钾将亚铁离子氧化生成铁离子,然后过滤得到滤液,滤液中含有氯酸钾、铁离子、HCl等,将滤渣用NaOH溶液溶解并过滤得到滤渣和含有VO3-溶液,向滤液中加入稀硫酸、硫酸铵,得到滤渣和固体NH4VO3,将NH4VO3焙烧得到V2O5和氨气,
(1)反应物的接触面积越大,反应速率越快,废钒催化剂需粉碎处理,目的是增大反应物接触面积,加快反应速率,故答案为:加快反应速率;
(2)步骤②中VO2+和C1O3-发生氧化还原反应,Cl元素化合价由+5价变为-1价,所以氯酸根离子作氧化剂,则VO2+作还原剂,化合价由+4价变为+5价,转移电子数是6,反应方程式为6VO2++ClO3-+6H2O=3V2O5↓+Cl-+12H+,
故答案为:6;1;6H2O;3V2O5↓;1;12H+;
(3)步骤②得到铁离子,调节溶液的pH使V2O5沉淀但不能使铁离子产生沉淀,结合图2及铁离子沉淀需要pH知,调节的pH范围是2.0-2.5,
故答案为:2.0~2.5;
(4)V2O5和NaOH溶液发生复分解反应生成NaVO3,反应方程式为V2O5+2NaOH=2NaVO3+H2O,
故答案为:V2O5+2NaOH=2NaVO3+H2O;
(5)硫酸铵溶液呈酸性,步骤④中需加人硫酸,抑制铵根离子水解,使NH4+的水解平衡向逆方向移动,增加NH4+的离子浓度,增加NH4VO3的产量,
故答案为:使NH4+的水解平衡向逆方向移动,增加NH4+的离子浓度,增加NH4VO3的产量;
(6)焙烧产生的气体是气体,用稀硫酸吸收得到硫酸铵,硫酸铵能循环利用,故答案为:硫酸;
(7)V2O5可制成某电池的电解液.该电池的总反应为:VO2++2H++V2+?V3+VO2++H2O,放电时的负极上V2+失电子发生氧化反应,电极反应式为V2+-e-=V3+,所以产物是V3+,故答案为:V3+.
点评 本题考查物质分离和提纯,为高频考点,涉及原电池原理、盐类水解、氧化还原反应、反应速率影响因素、基本操作等知识点,综合性较强,侧重考查基本原理,明确流程图中每一步发生的反应、物质性质及基本操作是解本题关键,注意从整体把握分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用药匙取用粉末状或颗粒状固体 | B. | 用胶头滴管滴加少量液体 | ||
| C. | 倾倒液体时试剂瓶标签面向手心 | D. | 给盛有$\frac{2}{3}$体积液体的试管加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食用植物油的主要成分是高级不饱和脂肪酸甘油酯 | |
| B. | 福尔马林可制备标本是利用了使蛋白质变性的性质 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 银氨溶液可以用于区分麦芽糖和蔗糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
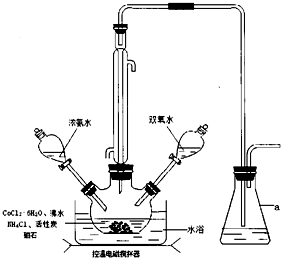
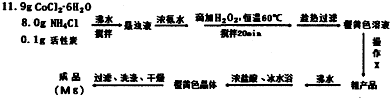
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:C>Li>B | B. | 元素的非金属性:N>O>F | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 氢化物的稳定性:HF>HCl>HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com