
����Ŀ���������ʵ���X��Y�����ܱ���������һ�������·�����Ӧ��X��g��+Y��g��Z ��s��+2W��g����ƽ��ʱW�����������%�����¶Ⱥ�ѹǿ�ı仯�����ʾ��
1.0 MPa | 2.0 MPa | 3.0 MPa | |
800�� | a | b | 83% |
900�� | c | 75% | d |
1000�� | 54% | e | f |
��a��c��f ��900�桢2.0MPaʱ��X��ת����Ϊ75% �۸÷�Ӧ�ġ�H��0 ��ƽ�ⳣ��K��1000�棩��K��800�棩�����١�������ȷ���У� ��
A.4��
B.3��
C.2��
D.1��
���𰸡�B
���������⣺��X��g��+Y��g��Z ��s��+2W��g������Ӧǰ��������������䣬����ͬ�¶��£�����Ӱ��ƽ���ƶ�����a=b=83%��c=d=75%��e=f=54%����a��c��f������ȷ����900��ʱ
X��g��+ | Y��g�� | Z ��s��+ | 2W��g�� | ||
��ʼ | n | n | 0 | ||
ת�� | x | x | 2x | ||
ƽ�� | n��x | n��x | 2x |
�� ![]() =75%�����x=
=75%�����x= ![]() n����900�桢2.0MPaʱ��X��ת����Ϊ
n����900�桢2.0MPaʱ��X��ת����Ϊ ![]() ��100%=75%������ȷ��
��100%=75%������ȷ��
���ɱ������ݿ�֪���¶�Խ�ߣ�ƽ��ʱW���������ԽС���������¶ȣ�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ������H��0������ȷ��
�ܷ��ȷ�Ӧ���¶�Խ�ߣ�KԽС��ƽ�ⳣ��K��1000�棩��K��800�棩���ʴ���
��ѡB��
�����㾫����������Ŀ����֪���������û�ѧƽ��ļ�������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���շ�Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������5.1 gþ���Ͻ�ķ�ĩ��������������У��õ�5.6 L H2����״���£���
��1���Ͻ���þ�����ʵ���Ϊ_______��
��2��д���úϽ���������NaOH��Һ�Ļ�ѧ����ʽ��_______��
������һ��������AlCl3��MgCl2�����Һ������һ����������������NaOH��Һ�����ɳ��������ʵ��������NaOH�����ʵ����Ĺ�ϵ��ͼ��ʾ��
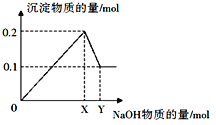
��1������Mg(OH)2������Ϊ__________��
��2��X=_______��Y=_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij�л���֮���ת����������̫���ܣ��罵��Ƭ��ϩ��NBD����̫�����տ�ת�����Ļ��飨Q�����䷴Ӧʽ�ɱ�ʾΪ�� 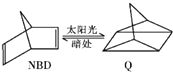 ��H=+88.62kJ/mol
��H=+88.62kJ/mol
�����й�˵������ȷ���ǣ� ��
A.һ�������£�1mol NBD������2 mol Br2�����ӳɷ�Ӧ
B.����Q��������NBD�ĵ�
C.����Q��һ��ȡ����ֻ��3��
D.NBD��Q����Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в������ܴﵽĿ���ǣ� ��
ѡ�� | Ŀ�� | ���� |
A | ����100mL1.0molL��1CuSO4 | ��25.0gCuSO45H2O��������ˮ���100mL��Һ |
B | ��ȥKNO3����������NaCl | ��������Ƴ��ȵı�����Һ����ȴ�ᾧ������ |
C | ������Һ�Ƿ���SO | ȡ��������Һ���Թ��У����������ữ��Ba��NO3��2��Һ |
D | ������Һ���Ƿ���NH | ȡ������Һ���Թ��У�����NaOH���ȣ����Թܿڷ���һƬʪ��ĺ�ɫʯ����ֽ |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����ij��E�ĺϳ�·����ͼ��ʾ�� 
��֪����2RCH2CHO ![]() R��
R�� ![]()
��A������ֻ����1��������D����Է�������Ϊ130��
��1��C�к��������ŵ�����Ϊ����Ӧ�ܵķ�Ӧ����ʽΪ��
��2���ںϳ�·���У���Ƣݺ͢ߵ�Ŀ����
��3��X��B�����ͬϵ���д��X������������Һ��Ӧ�����ӷ���ʽ��
��4�������й�˵����ȷ������
a��B����4�ֲ�ͬ����
b��ˮ����������NaHCO3��Ӧ���� ![]()
c��D��������Ʒ�Ӧ
d��1mol E�������ӳɣ��������4mol H2
��5��H�ж���ͬ���칹�壬������ͬʱ�������������Ĺ����֣������������칹��
���ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ��������FeCl3��Һ������ɫ��Ӧ��������5���⣬����ĸ�����Ϊ1��1��2��2��2��Ϊ��д�ṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڹ��ۻ������У�Ԫ�ػ��ϼ�����������Ҫԭ����( )
A.�����е�ʧ
B.���õ��Ӷ���ƫ��
C.���Ӽ��е�ʧ���е��Ӷ�ƫ��
D.�н���Ԫ�صĴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʷ��ӣ������ӣ���ˮ���ӽ�ϳ�ˮ�Ϸ��ӣ�ˮ�����ӣ��Ĺ����ǣ� ��
A.�������̣���������B.��ѧ���̣���������
C.�������̣��ų�����D.��ѧ���̣��ų�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ��֪������Fe3+>I2����FeCl2 ��Һ�еμӵ�ˮ: 2Fe2++I2=2Fe3++2I-
B. ��̼�������Һ�еμӹ����ȵ�����������ҺNH4++HCO3-+2OH-![]() NH3��+CO32��+2H2O
NH3��+CO32��+2H2O
C. �������еμӰ�ˮ: H++OH��= H2O
D. ͭ����ϡ����: Cu+4H++NO3-=Cu2++NO��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽�����������ķֽ�������������ͼװ����ʾ��ʵ�飬��K1��K2������ͨ��N2��һ��ʱ�����ȣ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ��BaCl2��Һ���а�ɫ����������Ʒ����Һ�к�ɫ��ȥ���������������Һ���ڴ�����������������˵���������

A. ����������Һ�����������ն����SO2����
B. ��Ӧ���ڲ����ĺ�ɫ��ĩ������Fe2O3
C. BaCl2��Һ��Ŀ���Ǽ���SO3�Ĵ���,�˴���Ba(NO3)2��ҺҲ���Լ���SO3
D. ��Ӧ���ڵõ�����������ͻ�ԭ�������ʵ���֮��Ϊ1:1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com