
【题目】下列离子方程式书写正确的是
A. 已知氧化性Fe3+>I2,则FeCl2 溶液中滴加碘水: 2Fe2++I2=2Fe3++2I-
B. 向碳酸氢铵溶液中滴加过量热的氢氧化钠溶液NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
C. 向盐酸中滴加氨水: H++OH-= H2O
D. 铜溶于稀硝酸: Cu+4H++NO3-=Cu2++NO↑+2H2O
科目:高中化学 来源: 题型:
【题目】现有200mL MgCl2、AlCl3的混合液,其中c(Mg2+)=0.2mol·L-1 ,c(Cl-)=1.3 mol·![]() 。要使Mg2+转化成Mg(OH)2,并使Mg2+和Al3+分离开来,至少需要4 mol·L-1的NaOH溶液
。要使Mg2+转化成Mg(OH)2,并使Mg2+和Al3+分离开来,至少需要4 mol·L-1的NaOH溶液
A. 140mL B. 120mL C. 100mL D. 80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量X和Y加入密闭容器,在一定条件下发生反应:X(g)+Y(g)Z (s)+2W(g),平衡时W的体积分数(%)随温度和压强的变化如表所示.
1.0 MPa | 2.0 MPa | 3.0 MPa | |
800℃ | a | b | 83% |
900℃ | c | 75% | d |
1000℃ | 54% | e | f |
①a>c>f ②900℃、2.0MPa时,X的转化率为75% ③该反应的△H<0 ④平衡常数K(1000℃)>K(800℃)上述①~④中正确的有( )
A.4个
B.3个
C.2个
D.1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 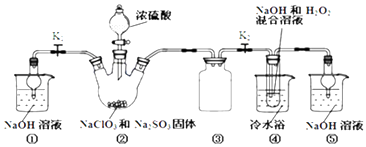
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)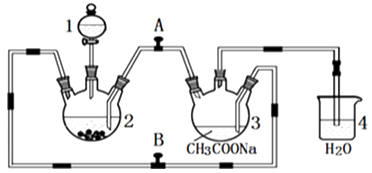
请回答下列问题:
(1)仪器1的名称是 .
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);目的是 .
A.盐酸和三氯化铬溶液同时加入 B.先加三氯化铬溶液一段时间后再加盐酸C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门 .
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 .
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O9.4g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物).
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+ , 最好往废液中通入足量的,再加入碱液,调节pH至少为才能使铬的离子沉淀完全(铬的离子浓度应小于10﹣5mol/L).【已知Cr(OH)3的溶度积为6.3×10﹣31 , ![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会祥云火炬将中国传统文化、奥运精神及现代科技融为一体,火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: 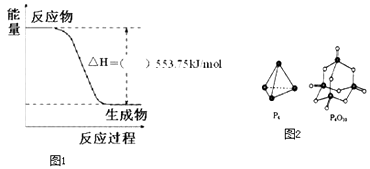
(1)如图1是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”).
写出表示丙烷燃烧热的热化学方程式:
(2)甲醇是一种清洁燃料,甲醇的燃烧热为726.51kJ/mol,若1mol甲醇和丙烷的混合物完全燃烧生成CO2和液态水共放出热量2498.4KJ,则混合物中甲醇和丙烷的物质的量之比为 .
(3)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式 .
(4)已知断裂下列化学键需要吸收的能量分别为P﹣P:akJmol﹣1、P﹣O:bkJmol﹣1、P=O:ckJmol﹣1、O=O:dkJmol﹣1 . 根据如图2所示的分子结构和有关数据估算反应:P4(s)+5O2(g)=P4O10(s)的△H=kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A. Mg2+、Al3+、Ba2+ B. H+、Mg2+、Al3+
C. H+、Cu2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.浓硫酸能与铜反应释放出氢气
B.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学方程式
(1)乙烯与溴的反应
(2)乙酸和乙醇浓硫酸供热
(3)苯酚与氢氧化钠溶液的反应化学方程式:
(4)苯酚具有弱酸性,其酸性比碳酸(填强或弱)依据是(写化学方程式)
(5)通过乙醇制乙烯的反应 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com