
【题目】下列说法中不正确的是( )
A.浓硫酸能与铜反应释放出氢气
B.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
科目:高中化学 来源: 题型:
【题目】下列操作不能达到目的是( )
选项 | 目的 | 操作 |
A | 配制100mL1.0molL﹣1CuSO4 | 将25.0gCuSO45H2O溶于蒸馏水配成100mL溶液 |
B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 检验溶液是否含有SO | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
D | 检验溶液中是否含有NH | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 已知氧化性Fe3+>I2,则FeCl2 溶液中滴加碘水: 2Fe2++I2=2Fe3++2I-
B. 向碳酸氢铵溶液中滴加过量热的氢氧化钠溶液NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
C. 向盐酸中滴加氨水: H++OH-= H2O
D. 铜溶于稀硝酸: Cu+4H++NO3-=Cu2++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.
(1)用CO可以合成甲醇.已知:
①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
则CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1
下列措施中能够增大上述合成甲醇反应的反应速率的是(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2 , 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图1所示. 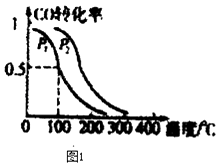
①p1p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=;
③100℃时,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2号 CH3OH各0.5amol,则平衡(填“向右”、“向左”或“不”移动)
④在其它条件不变的情况下,再增加a mol CO和2a molH2 , 达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”).
(3)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示.在T1﹣T2及T4﹣T5两个温度区间,容器内甲醇的体积分数的变化趋势如图2所示,其原因是 . 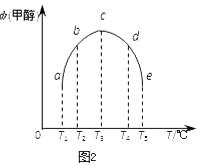
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
A.①②③⑥
B.②④⑤⑥
C.②④⑥
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是__________。
(2)调节反应A的pH范围为__________,可以选择的试剂是__________(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________。
(4)已知滤液中含有碳酸氢纳,写出生成碱式碳酸铜的离子方程式:__________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种重要的液态火箭燃料,具有强还原性,工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3等物质。
(1)下列物质的摩尔质量与肼的摩尔质量相同的是______(填字母)。
A.氧气 B.硫化氢 C.硅化氢 D.氟气
(2)上述生成水合肼的反应中尿素作_____(填“氧化剂”或“还原剂”),上述反应的化学方程式为_________________。
(3)发射“神舟飞船的长征火箭用肼作燃料,以二氧化氮作氧化剂,两者反应会生成氮气和水。该反应中每生成6.72L(标准状况)N2,转移电子的物质的量为________。
(4)肼燃烧易产生NO,可用漂白粉溶液脱除NO。为提高NO的脱除率,在其他条件相同时,向漂白粉溶液中分别加入三种不同添加剂,测得其对NO脱除率的影响如图所示。由图可知,KMnO4、H2O2、NaClO2的氧化性由弱到强的顺序是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了如图所示的实验装置。
已知:① 氯气和碱反应放出热量。
②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O

请回答下列问题:
(1)甲装置中仪器a的名称是_______,该装置中发生反应的离子方程式为_______。
(2)装置丁中NaOH的作用是_______。
(3)①制取漂白粉的化学方程式是_______。
②小组制得的漂白粉中n(CaCl2 )远大于n[ Ca(ClO)2],主要原因可能是_______。
(4)为提高Ca(ClO)2的含量,可采取的措施是_______ (任写一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com