
����Ŀ����(N2H4)��һ����Ҫ��Һ̬���ȼ�ϣ�����ǿ��ԭ������ҵ����������[CO(NH2)2]��NaClO��NaOH��Һ�з�����Ӧ����ˮ����(N2H4��H2O)��Na2CO3�����ʡ�
��1���������ʵ�Ħ���������µ�Ħ��������ͬ����______(����ĸ)��
A.���� B.���� C.�軯�� D.����
��2����������ˮ���µķ�Ӧ��������_____(������������������ԭ����)��������Ӧ�Ļ�ѧ����ʽΪ_________________��
��3�����������۷ɴ��ij������������ȼ�����Զ��������������������߷�Ӧ�����ɵ�����ˮ���÷�Ӧ��ÿ����6.72L(��״��)N2��ת�Ƶ��ӵ����ʵ���Ϊ________��
��4����ȼ���ײ���NO������Ư����Һ�ѳ�NO��Ϊ���NO���ѳ�����������������ͬʱ����Ư����Һ�зֱ�������ֲ�ͬ���Ӽ���������NO�ѳ��ʵ�Ӱ����ͼ��ʾ����ͼ��֪��KMnO4��H2O2��NaClO2��������������ǿ��˳����_______________��

���𰸡� AC ��ԭ�� CO(NH2)2+NaClO+2NaOH=N2H4��H2O+Na2CO3+NaCl 0.8mol NaClO2<H2O2<KMnO4
����������1���µ�Ħ��������32g/mol��ѡ�����������ʵ�Ħ�������ֱ���32g/mol��34g/mol��32g/mol��38g/mol����ѡAC����2�������е�Ԫ�ػ��ϼ۴ӣ�3�����ߵ���2�ۣ�������������ˮ���µķ�Ӧ����������ԭ��������������������������ԭ���غ��֪����̼���ƺ��Ȼ������ɣ���������Ӧ�Ļ�ѧ����ʽΪCO(NH2)2+NaClO+2NaOH��N2H4��H2O+Na2CO3+NaCl����3����Ӧ�ķ���ʽΪ2N2H4+2NO2=3N2+4H2O��ÿ����3mol����ת��8mol���ӣ���˷�Ӧ��ÿ����6.72L(��״��)N2��0.3mol����ʱ��ת�Ƶ��ӵ����ʵ���Ϊ0.8mol����4����ͼ��֪������ص��ѳ�����ߣ������˫��ˮ������KMnO4��H2O2��NaClO2��������������ǿ��˳����NaClO2<H2O2<KMnO4��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ����ȡClO2 �� ����ClO2Ϊԭ���Ʊ��������ƣ�NaClO2��һ�ָ�Ч��������Ư��������֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl�� 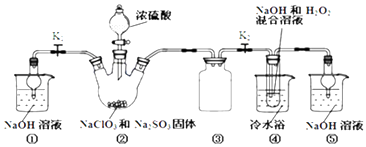
���������գ�
��1��װ�â��в���ClO2�Ļ�ѧ����ʽΪ��װ�â��з�����Ӧ�����ӷ���ʽΪ ��
��2��װ�â۵���������װ�âٺ͢��ڱ�ʵ���е����� ��
��3��װ�âܷ�Ӧ�����Һ�л���������NaOH���ʣ��Ӹ���Һ�����ˮNaClO2����IJ�������Ϊ���ټ�ѹ��55�����������ᾧ���ڳ��ȹ��ˣ�����50�����ҵ���ˮϴ�ӣ��ܵ���60�����õ���Ʒ�����������50�����ҵ���ˮϴ�ӵ�ԭ���� ��
��4���������ƴ��Ȳⶨ����ȷ��ȡ��������������Ʒ10.0g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ�������û��Һ���250mL������Һ����ȡ25.00mL����Һ����2.0 molL��1Na2S2O3��Һ�ζ���I2+2S2O32��=2I��+S4O62�������Ե�����Һ��ָʾ�����ﵽ�ζ��յ�ʱ������Ϊ �� �ظ��ζ�3�Σ�������������ʾ�������Ʒ��NaClO2����������Ϊ ��
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
��5��ʵ���������NaClO2���ʿɷֽ�ΪNaClO3��NaCl��ȡ������NaClO2 �� ����һ�ݼ��ȸ���60��ʹ֮���ʣ���һ���ϸ棬�������Һ�����ֱ�������FeSO4��Һ��Ӧʱ������Fe2+�����ʵ��������ͬ��������ͬ�������жϡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ����( )
A��Ũ��������ͭ��Ӧ�ͷų�����
B��Ũ�����������ȵ�ľ̿��Ӧ�����ɶ�����̼�Ͷ�������
C��Ũ���������ˮ�ԣ���ʵ���г����������
D�����Ũ������������ʻ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ڷ���ʽ��д��ȷ����
A. ���ˮ�е���FeCl3������Һ:Fe3+ +3H2O![]() Fe(OH)3��+3H+
Fe(OH)3��+3H+
B. ��NaOH ��Һ��ͨ�������������:OH-+SO2=HSO3-
C. ��һС����Ͷ��ˮ��:Na+2H2O=Na++2OH-+H2��
D. ��Fe(NO3)3��Һ�м������HI��Һ:2Fe3++2I-=2Fe2++I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������ұ������������¯�н��еģ������ķ�Ӧ�� Fe2O3+3CO=2Fe+3CO2���˷�Ӧ����
A�����Ϸ�Ӧ B��������ԭ��Ӧ
C���û���Ӧ D���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����л�ѧ����ʽ
��1����ϩ����ķ�Ӧ
��2��������Ҵ�Ũ���ṩ��
��3������������������Һ�ķ�Ӧ��ѧ����ʽ��
��4�����Ӿ��������ԣ������Ա�̼������ǿ�����������ǣ�д��ѧ����ʽ��
��5��ͨ���Ҵ�����ϩ�ķ�Ӧ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������ӵ����ʵ���������(����)
A.4��ʱ2.7mLˮB.��6.02��1023����ԭ�ӵ�һ����̼
C.6.02��1022���Ȼ������D.4.9g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2O��һ��ǿ��������������ˮ�һ���ˮ��Ӧ���ɴ����ᣬ���л����ԭ���Ӵ��ᷢ��ȼ�ղ���ը��һ����ȡCl2O��װ����ͼ��ʾ��

��֪��Cl2O���۵�Ϊ-116�棬�е�Ϊ3.8 ����Cl2�ķе�Ϊ-34.6����HgO+2Cl2=HgCl2+Cl2O������˵����ȷ����
A. װ�â�������ʢװ���Լ�������Ũ����ͱ���ʳ��ˮ
B. ͨ���������Ŀ������������
C. ��װ�â����ݳ��������Ҫ�ɷ���Cl2O
D. װ�â����֮�䲻����Ƥ�����ӣ���Ϊ�˷�ֹ��Ƥ��ȼ�պͱ�ը
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com