
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是__________。
(2)调节反应A的pH范围为__________,可以选择的试剂是__________(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________。
(4)已知滤液中含有碳酸氢纳,写出生成碱式碳酸铜的离子方程式:__________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________。
【答案】 将Fe2-氧化成Fe3+ 3.7~6.0 cd 水浴加热 2Cu2++![]() +2H2O=Cu2(OH)2CO3+
+2H2O=Cu2(OH)2CO3+![]() 取最后一次洗涤液,加入硝酸银、硝酸溶液,无沉淀生成则表明已洗净
取最后一次洗涤液,加入硝酸银、硝酸溶液,无沉淀生成则表明已洗净
【解析】电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)加具有氧化性的物质氯酸钠,把亚铁离子氧化物铁离子,加入CuO(或氢氧化铜、碳酸铜等)调节pH使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,在滤液中加碳酸钠,生成碱式碳酸铜,过滤得到碱式碳酸铜固体。
(1)根据表中数据可知铁离子在pH=3.7时,即可完全沉淀,则容易转化为沉淀除去,所以要加入氧化剂氯酸钠把亚铁离子氧化为铁离子,故答案为:将Fe2+氧化成Fe3+;
(2)调节溶液A的pH使铁离子转化为沉淀,而铜离子不沉淀,则调节溶液A的pH范围为3.7-6.0;调节pH时,加入的试剂能消耗氢离子,但是不能引入新的杂质,则可以选用氢氧化铜和碳酸铜;故答案为:3.7-6.0;cd;
(3)反应B的温度要控制在60℃左右,且保持恒温,由于反应温度较低,则可采用水浴加热的方法;故答案为:水浴加热;
(4)氯化铜与碳酸钠反应生成碱式碳酸铜和碳酸氢钠,其反应的离子方程式为:2Cu2++3CO32-+2H2O=Cu2(OH)2CO3+2HCO3-;故答案为:2Cu2++3CO32-+2H2O=Cu2(OH)2CO3+2HCO3-;
(5)沉淀表面会附着氯离子,设计实验检验是否含有氯离子的方法可以检验是否洗涤干净,实验设计为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净,故答案为:取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | CaCO3 | NaCl | HNO3 |
弱电解质 | CH3COOH | H3PO4 | NH3 | Fe(OH)3 |
非电解质 | 蔗糖 | 酒精 | BaSO4 | Al2O3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会祥云火炬将中国传统文化、奥运精神及现代科技融为一体,火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题: 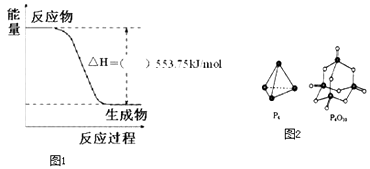
(1)如图1是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”).
写出表示丙烷燃烧热的热化学方程式:
(2)甲醇是一种清洁燃料,甲醇的燃烧热为726.51kJ/mol,若1mol甲醇和丙烷的混合物完全燃烧生成CO2和液态水共放出热量2498.4KJ,则混合物中甲醇和丙烷的物质的量之比为 .
(3)已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式 .
(4)已知断裂下列化学键需要吸收的能量分别为P﹣P:akJmol﹣1、P﹣O:bkJmol﹣1、P=O:ckJmol﹣1、O=O:dkJmol﹣1 . 根据如图2所示的分子结构和有关数据估算反应:P4(s)+5O2(g)=P4O10(s)的△H=kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
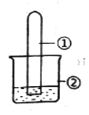
选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.浓硫酸能与铜反应释放出氢气
B.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫
C.浓硫酸具有吸水性,在实验中常用作干燥剂
D.冷的浓硫酸可以用铁质或铝质容器储存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
工业上常利用含硫废水生产Na2S2O3 ·5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程。实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品。
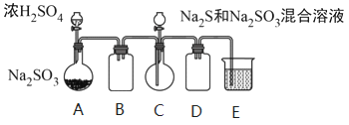
已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(b)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (c)
Na2S2O3(aq) (c)
ii.BaS2O3易溶于水。
(1)E中的试剂是__________。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为__________。
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是__________。
(4)产品中常含有Na2SO3和Na2SO4。该小组设计了以下实验方案进行检验。
步骤 | 实验操作 | 实验现象 |
Ⅰ | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
Ⅱ | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量__________ | 沉淀未完全溶解,并有刺激性气味的气体产生 |
①步骤Ⅱ中加入的试剂可以是__________(填序号)。
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤Ⅱ设计过滤操作的目的是(用化学方程式简要文字表述)__________。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是__________。
(6)Na2S2O3常用作脱氯剂。Na2S2O3溶液与Cl2反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离于方程式书写正确的是
A. 向沸水中滴入FeCl3饱和溶液:Fe3+ +3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 向NaOH 溶液中通入过量二氧化硫:OH-+SO2=HSO3-
C. 将一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑
D. 向Fe(NO3)3溶液中加入过量HI溶液:2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是 Fe2O3+3CO=2Fe+3CO2,此反应属于
A、化合反应 B、氧化还原反应
C、置换反应 D、分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,各1L的 0.1 mol·L-1的HX溶液与0.1 mol·L-1某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是

A.HX为一种弱酸,ROH为弱碱
B.a、b两点由水电离出c(H+)均为10-12mol·L-1
C.两溶液等体积混合: c(X-) = c(R+)+ c(ROH)
D.两溶液等体积混合:c(R+)>c(X-)>c(OH-) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com