
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | CaCO3 | NaCl | HNO3 |
弱电解质 | CH3COOH | H3PO4 | NH3 | Fe(OH)3 |
非电解质 | 蔗糖 | 酒精 | BaSO4 | Al2O3 |
A. A B. B C. C D. D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4 ![]() HC2O4-+ H+ Ka 1 ; HC2O4-
HC2O4-+ H+ Ka 1 ; HC2O4- ![]() C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
A.常温下,Ka1 :Ka2 =1000
B.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得 pH为4.2的混合液
C.pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4)
D.向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.9g甲基(﹣CH3)所含有的电子数是10 NA个
B.22.4L乙烷中含有的共价键数为7NA个
C.常温下,14g乙烯和丙烯的混合物中总原子数为3NA个
D.4.2g C3H6中含有的碳碳双键数一定为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
(1)正四面体烷的二氯取代产物有种.
(2)关于乙烯基乙炔分子的说法正确的是 .
A.能使酸性KMnO4溶液褪色
B.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
C.乙烯基乙炔分子内含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子发生加聚反应的化学方程式
(4)写出与苯互为同系物且一氯取代产物只有两种的物质的结构简式(举两例):、 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作不能达到目的是( )
选项 | 目的 | 操作 |
A | 配制100mL1.0molL﹣1CuSO4 | 将25.0gCuSO45H2O溶于蒸馏水配成100mL溶液 |
B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 检验溶液是否含有SO | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
D | 检验溶液中是否含有NH | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是( )
①C(s)+O2(g)═CO2(g)△H1 C(s)+ ![]() O2(g)═CO(g)△H2
O2(g)═CO(g)△H2
②S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2
③H2(g)+ ![]() O2(g)═H2O(l)△H1 2H2(g)+O2(g)═2H2O(l)△H2
O2(g)═H2O(l)△H1 2H2(g)+O2(g)═2H2O(l)△H2
④CaCO3(s)═CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)═Ca(OH)2(s)△H2 .
A.①
B.②③④
C.③④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定条件下A、B、C、D之间的转化关系如右图所示。下列说法正确的是
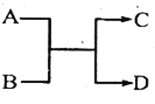
A. 若A为Fe,D为氢气,则B一定为酸
B. 若A、D为化合物,B为水,则C一定是气体单质
C. 若A、B、C、D均为化合物,该反应一定属于复分解反应
D. 若A、B、C、D均为10电子微粒(分子或离子),且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有FeCl3、CuCl2、FeCl2)制备,其制备过程如下:

查阅资料知,通过调节溶液的酸碱度可使Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 6.0 | 7.5 | 1.4 |
沉淀完全pH | 13 | 14 | 3.7 |
(1)氯酸钠的作用是__________。
(2)调节反应A的pH范围为__________,可以选择的试剂是__________(填序号)。
a.氨水 b.硫酸铜 c.氢氧化铜 d.碳酸铜
(3)反应B的温度要控制在60℃左右,且保持恒温,可采用的加热方法是__________。
(4)已知滤液中含有碳酸氢纳,写出生成碱式碳酸铜的离子方程式:__________。
(5)过滤得到的产品洗涤时,如何判断产品已经洗净__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com