
【题目】最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942 kJ热量,根据以上信息和数据,下列说法正确的是

A.N4属于一种新型的化合物
B.N4与N2互称为同位素
C.N4沸点比P4(白磷)高
D.1 mol N4气体转变为N2将放出882 kJ热量
科目:高中化学 来源: 题型:
【题目】相同物质的量的下列有机物,充分燃烧,消耗氧气的量相同的是
A. C3H4和C2H6B. C3H6和C3H8O
C. C3H6O2和C3H8OD. C3H8O和C4H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标。250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)此温度下该反应的平衡常数表达式K=___;
(2)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-890.3kJmol-1
②CO(g)+H2O(g)═CO2(g)+H2(g) △H=+2.8kJmol-1
③2CO(g)+O2(g)═2CO2(g) △H=-566.0kJmol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的△H=___kJmol-1。
2CO(g)+2H2(g)的△H=___kJmol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】示踪原子法是研究化学反应的重要方法之一,下列化学方程式正确的是( )
A.2Na218O2+2H2O=4NaOH+18O2↑
B.2KMnO4+5H218O2+3H2SO4=K2SO4+2MnSO4+518O2↑+8H2O
C.CH3C18OOH+CH3OH![]() CH3CO18OCH3+H2O
CH3CO18OCH3+H2O
D.6H37Cl+NaClO3=NaCl+37Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是
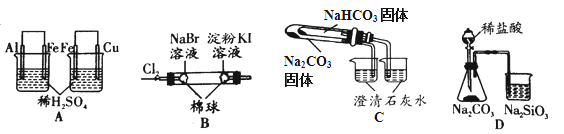
实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R的原子核外电子数等于核内中子数,2.8 g该元素(设其相对原子质量与R原子的质量数相等)的单质R与氧气充分反应,可得到6.0 g化合物RO2,则下列有关说法错误的是( )
A.该元素原子的质子数为13
B.该元素原子的中子数为14
C.该元素原子的最外层电子数为4
D.该元素原子具有3个电子层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>____________。基态K+电子占据最高能级的电子云轮廓图为________形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______,中心原子的杂化形式为_______。NaBH4中存在_____(填标号)。
a. 离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为________,其中Be的配位数为_______。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:_____________________。
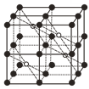
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是________。若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述中,完全正确的是( )
)的下列叙述中,完全正确的是( )
①能使酸性KMnO4溶液褪色;②可发生加聚反应;③难溶于水;④可溶于苯中;
⑤苯环能与溴水发生取代反应;⑥所有的原子可能共面,且最多有5个原子共线。
A.①②④B.②④⑥C.①②③④D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com