
【题目】(1)甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知:甲醇的燃烧热486为kJ·mol-1 ( 2CO (g) + O2(g) = 2CO2(g) △H b =-566.0 kJ·mol-1)
试写出CH3OH(l)在氧气中完全燃烧生成CO和H2O(l)的热化学方程式: 。
(2)常温下某溶液中由水电离的c(H+)=10-10 mol/L,则该溶液的pH为 _______。
(3)常温下,向V L pH=12的Ba(OH)2溶液中逐滴加入一定浓度的NaHSO4稀溶液,当溶液中的Ba2+恰好沉淀完全时,溶液pH=11。则Ba(OH)2溶液与NaHSO4溶液的体积比为__________,NaHSO4溶液的物质的量浓度为 。
(4)常温下,0.5mol/L的NH4Cl溶液的为pH=5.该溶液显酸性的原因是(用离子方程式表示) 。计算常温下氨水的电离平衡常数为 。
【答案】(1) 2CH3OH(l)+3O2(g)=2CO(g)+4H2O(l) △H=-406kJ/mol
(2)4或10 (2分)(3)1∶4(2分)0.00125mol/L (2分)
(4)NH4++H2O![]() NH3·H2O+H+ (2分) 5×10-5 (2分)
NH3·H2O+H+ (2分) 5×10-5 (2分)
【解析】
试题分析:(1)已知:甲醇的燃烧热486为kJ·mol-1 ,则
①CH3OH(l)+2O2(g)=CO2(g)+2H2O(l) △H=-486kJ/mol
又因为反应②2CO (g) + O2(g) = 2CO2(g) △Hb =-566.0 kJ·mol-1
根据盖斯定律可知①×2-②即得到CH3OH(l)在氧气中完全燃烧生成CO和H2O(l)的热化学方程式为2CH3OH(l)+3O2(g)=2CO(g)+4H2O(l) △H=-406kJ/mol。
(2)常温下某溶液中由水电离的c(H+)=10-10 mol/L,则该溶液中水的电离被抑制,溶液可能是酸或碱,因此溶液的pH为4或10。
(3)VL pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,含有的氢氧根离子物质的量为V×10-2mol=0.01Vmol。溶液中的Ba2+恰好完全沉淀时反应的硫酸氢钠物质的量为0.5V×10-2mol=0.005Vmol,设硫酸氢钠溶液体积为x,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:c(OH-)=10-3mol/L,则:(0.01Vmol0.005Vmol)/(x+VL)=10-3,解得:x=4VL,则Ba(OH)2溶液与NaHSO4溶液的体积比为VL:4VL=1:4;该硫酸氢钠溶液的浓度为:0.005Vmol÷4VL=1.25×10-3 molL-1。
(4)铵根水解溶液显酸性,水解方程式为NH4++H2O![]() NH3·H2O+H+;常温下,0.5mol/L的NH4Cl溶液的为pH=5,溶液中氢离子浓度是10-5mol/L,生成的一水合氨的浓度也约是10-5mol/L,铵根的浓度约是0.5mol/L,氢氧根的浓度是10-9mol/L,因此常温下氨水的电离平衡常数为
NH3·H2O+H+;常温下,0.5mol/L的NH4Cl溶液的为pH=5,溶液中氢离子浓度是10-5mol/L,生成的一水合氨的浓度也约是10-5mol/L,铵根的浓度约是0.5mol/L,氢氧根的浓度是10-9mol/L,因此常温下氨水的电离平衡常数为![]() =5×10-5。
=5×10-5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物的性质相似。现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的PH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数;假设Zn2+的浓度为10-5mol/L时,已沉淀完全)。则下列说法不正确的是

A. 某废液中含Zn2+,沉淀对Zn2+以控制溶液pH的范围是(8,12 ) ,
B. 往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
C. 向1L 0.01mol/LZnCl2溶液中逐渐滴加NaOH溶液,当PH>6时Zn2+开始沉淀
D. 向1L 0.01mol/LZnCl2溶液中逐渐滴加NaOH溶液至PH=7,此时溶液中Zn2+的浓度为10-3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,下列各种情况下一定能大量共存的离子组为
A.pH=7的溶液中:Fe3+、Cl-、Na+、NO![]()
B.由水电离出的c(H+)=1×10-13 mol·L-1的水溶液中Na+、CO![]() 、Cl-、K+
、Cl-、K+
C.无色透明的酸性溶液中NH![]() 、NO
、NO![]() 、Al3+、Cl-
、Al3+、Cl-
D.Al3+、HCO![]() 、I-、Ca2+
、I-、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有HCO3﹣、SO32﹣、Cl﹣和Na+ , 若向其中通入足量的Cl2 , 溶液中上述四种离子的浓度基本保持不变的是( )
A.HCO3﹣
B.SO32﹣
C.Cl﹣
D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中一定正确的是
A. 一定条件下某密闭容器盛2 mol N2与3 mol H2反应生成的NH3分子数为2NA
B. 25 ℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA
C. 一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA
D. 1 L 0.1mol·L-1的NaHCO3溶液中HCO![]() 和CO
和CO![]() 的离子数之和为0.1NA
的离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图,下列说法正确的是( )
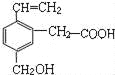
A. 该有机物的分子式为C11H15O3
B. 该有机物不能发生取代反应
C. 1 mol该物质与足量的钠反应可以生成1 mol氢气
D. 1 mol该有机物可以与1 mol碳酸钠发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①均匀混合气体;②_____________③_____________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应_____________。
(3)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
(4)D装置的石棉中均匀混有KI粉末,其作用是___________________。
(5)E装置的作用是___________________(填编号)。
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年入冬以来,简阳的雾霾较为严重,NO是引起原因之一。综合治理空气污染是环境化学当前主要研究的内容。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化。
①已知 2NO(g)+2CO(g)![]() N2(g)+2CO2(g)反应能自发进行,则该为___________反应(填“吸热”或“放热”)。
N2(g)+2CO2(g)反应能自发进行,则该为___________反应(填“吸热”或“放热”)。
②上述反应在绝热、恒容密闭容器中进行,并在 t1时可达到平衡(图中 ω、M、v 正分别表示质量分数、混合气体平均相对分子质量和正反应速率),则下列示意图中符合题意的是___________(填选项序号)。

(2)在25℃、101kPa下,将2 mol NO、2.4 mol CO通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

①NO的转化率为 ,0~15min 内,v(NO) = 。
②20min 时若改变反应条件,导致CO浓度下降,则改变的条件可能是 (填选项序号)。
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容器体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com