
A、 气体除杂 气体除杂 |
B、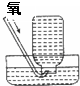 收集氧气 |
C、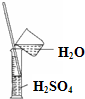 稀释溶液 |
D、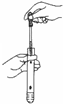 滴加溶液 |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 |
这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 |
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、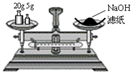 称量氢氧化钠固体 |
B、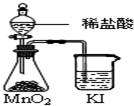 比较MnO2、Cl2、I2的氧化性 |
C、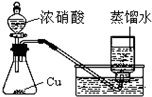 制取少量NO2 |
D、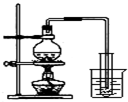 实验室制取蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B、逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C、正、逆反应速率都减小,平衡向逆反应方向移动 |
| D、正、逆反应速率都减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol,甲烷的燃烧热为802 kJ/mol |
| B、等量H2在O2中完全燃烧,生成H2O(g)比生成H2O(l)放出的热量多 |
| C、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
| D、由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气、二氧化硫均能使品红溶液褪色,说明二者均有氧化性 |
| B、铁与稀硝酸,稀硫酸反应均有气泡产生,说明铁与两种酸均能发生置换反应 |
| C、向溶液中滴加酸化的硝酸钡溶液出现白色沉淀,说明该溶液中一定有硫酸根离子 |
| D、分别充满氯化氢气体,氨气的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
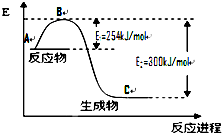 氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用. | 化学键 | H-H | N≡N |
| 键能/kJ?mol-1 | 435 | 943 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 到达平衡的时间(min) | 5 | 8 | |
| N2的浓度(mol/L) | C1 | 1.5 | |
| NH3的体积分数 | w1 | W3 | |
| 混合气体密度(g/L) | ρ1 | ρ2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com