
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
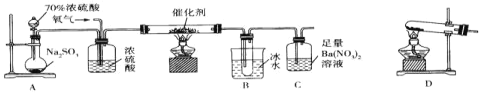
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
【答案】B
【解析】
A.70%的浓硫酸和亚硫酸钠反应产生二氧化硫,A装置烧瓶中发生的反应可以表示为:SO32-+2H+=SO2↑+H2O,故A正确;
B.D装置加热固体制备氧气,可以用KMnO4,加热分解KClO3,需要MnO2作催化剂,故B错误;
C.对于定量测定实验,需要排除空气、水蒸气的干扰,还要将产物三氧化硫以及未反应的二氧化硫全部驱赶到后续装置中以进行准确测量或称量,故停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,故C正确;
D.装置C中发生反应为:3SO2+3Ba2++2NO3-+2H2O=4H++2NO↑+3BaSO4↓,白色沉淀为BaSO4,故D正确;
故答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,可用于除油污,写出CO32﹣水解的离子方程式_______________________。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式_______________________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中
c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为_____(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1)。可使溶液A和溶液B的 pH相等的方法是___。
A 向溶液A中加适量NaOH B 向溶液A中加适量水
C 向溶液B中加适量NaOH D 向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是______。
A.c(Na+)>2c(SO32-)>c(HSO3-)
B.c(Na+)=c(SO32﹣) +c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)> c(H+)=c(OH﹣)
②利用如图中数据,求H2SO3![]() H++ HSO3﹣的平衡常数的数值_____(保留两位小数)。
H++ HSO3﹣的平衡常数的数值_____(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述错误的是()
A.  与Cl2在光照条件下的取代产物有3种
与Cl2在光照条件下的取代产物有3种
B. 分子式为C7H8O且属于芳香族化合物的同分异构体有5种
C. 丙烷的一氯代物有2种,丙烷的二氯代物有4种
D. 联苯![]() 的一氯代物有3种,二氯代物有12种
的一氯代物有3种,二氯代物有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. SiO2、SiCl4的相对分子质量不同,所以沸点不同
B. NH4C1与NaOH所含化学键类型和晶体类型均相同
C. 金属Ag的堆积方式是面心立方最密堆积
D. CO2与水反应过程中,有共价键的断裂和形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
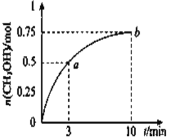
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①Fe(s)+1/2O2(g)=FeO(s) ΔH1=-272.0kJ·mol-1;
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____(填“正”或“负”)极。F电极上的电极反应式为________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因______。


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合金A由两种常见的金属组成。为测定其组成,某同学的实验流程如图所示:

请回答:
(1)合金A中的两种金属为_____(填化学式)。
(2)过程②中分离C和E的化学实验基本操作是________。
(3)溶液H中所含的阳离子有_____(用离子符号表示)。
(4)为测定合金的组成,若需要称量沉淀F的质量,则F需要洗涤,证明沉淀F洗涤干净的方法是_____________________。
(5)写出②③及由溶液H和氨水反应生成白色沉淀的离子方程式(没有离子方程式的写化学方程式):
过程②___________________;
______________________;
_______________________。
过程③_______________。
溶液H与氨水:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用以下方法处理尾气中的![]()
方法一:活性炭还原法:![]() ,一定条件下,各物质浓度与时间的关系如图:
,一定条件下,各物质浓度与时间的关系如图:
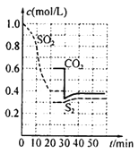
(1)该反应的平衡常数表达式为K=________,第一次达到平衡的时间是第_____min。
(2)0~20min化学反应速率表示υ(SO2)= _________。
(3)30min时平衡发生移动的条件是__________________。
方法二:亚硫酸钠吸收法
(1)![]() 溶液吸收
溶液吸收![]() 的离子方程式为_______________________。
的离子方程式为_______________________。
(2)常温下,当![]() 完全转化为
完全转化为![]() 时,溶液中相关离子浓度关系为:
时,溶液中相关离子浓度关系为:
![]() ______
______![]() (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
![]() ______
______![]() (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com