
【题目】可用以下方法处理尾气中的![]()
方法一:活性炭还原法:![]() ,一定条件下,各物质浓度与时间的关系如图:
,一定条件下,各物质浓度与时间的关系如图:
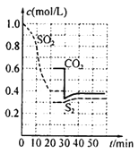
(1)该反应的平衡常数表达式为K=________,第一次达到平衡的时间是第_____min。
(2)0~20min化学反应速率表示υ(SO2)= _________。
(3)30min时平衡发生移动的条件是__________________。
方法二:亚硫酸钠吸收法
(1)![]() 溶液吸收
溶液吸收![]() 的离子方程式为_______________________。
的离子方程式为_______________________。
(2)常温下,当![]() 完全转化为
完全转化为![]() 时,溶液中相关离子浓度关系为:
时,溶液中相关离子浓度关系为:
![]() ______
______![]() (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
![]() ______
______![]() (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
【答案】K=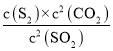 20 0.03mol/(Lmin) 减小CO2的浓度 SO32-+SO2+H2O→2HSO3- = >
20 0.03mol/(Lmin) 减小CO2的浓度 SO32-+SO2+H2O→2HSO3- = >
【解析】
方法一:(1)根据平衡常数的定义书写表达式;当反应达到平衡后反应体系中各物质的量不再随时间变化而变化;
(2)根据υ=![]() 计算υ(SO2);
计算υ(SO2);
(3)30min时瞬间,二氧化碳浓度降低,SO2、S2的浓度不变,而后二氧化碳、S2的浓度均增大;
方法二:(1)Na2SO3溶液与SO2反应生成亚硫酸氢钠;
(2)结合反应后溶液中的电荷守恒和物料守恒判断。
方法一:(1)反应![]() 的平衡常数表达式K=
的平衡常数表达式K=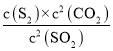 ;由图像可知当反应进行到20min时SO2、CO2和S2的物质的量浓度不再随时间的变化而变化,此时反应达到平衡状态;
;由图像可知当反应进行到20min时SO2、CO2和S2的物质的量浓度不再随时间的变化而变化,此时反应达到平衡状态;
(2)由图可知,0~20min内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故υ(SO2)=![]() =0.03mol/(Lmin);
=0.03mol/(Lmin);
(3)30min时瞬间,二氧化碳浓度降低,SO2、S2的浓度不变,而后二氧化碳、S2的浓度均增大,30min时瞬间应是减少CO2的浓度;
方法二:
(1)Na2SO3溶液与SO2反应生成亚硫酸氢钠,反应离子方程式为:SO32-+SO2+H2O→2HSO3-;
(2)反应后溶液中存在电荷守恒,即:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-);溶液中S元素以SO32-、HSO3-、H2SO3形式存在,Na元素与硫元素物质的量之比为1:1,故溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO4),则c(Na+)>c(SO32-)+c(HSO3-)。


科目:高中化学 来源: 题型:
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
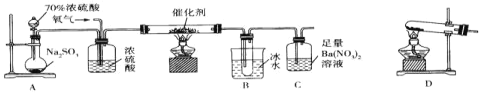
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.b为正极、a为负极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 F 是一种常见的化工原料,合成方法如下:
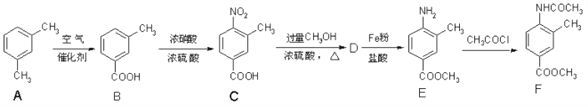
完成下列填空:
(1)化合物 C 中含氧官能团的名称是___________和__________。
(2)任写一种含苯环的 A 的同分异构体的结构简式: _________________。
(3)B→C 的反应类型是___________。
(4)写出 C→D 的化学方程式:_________________________________________。
(5)已知: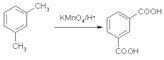 ,设计一条以
,设计一条以![]() 为原料合成
为原料合成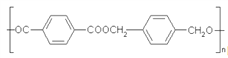 的合成路线。___________________。
的合成路线。___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将两种不同浓度的某一元酸HA分别与NaOH溶液等体积混合(混合后溶液体积等于混合前两溶液体积之和),测得反应后溶液的pH如表所示。下列判断错误的是( )
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
c(HA) | c(NaOH) | ||
① | 0.10 | 0.10 | 9 |
② | x | 0.05 | 7 |
A.HA是弱酸
B.![]()
C.实验①所得溶液中:![]() mol/L
mol/L
D.实验②所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂存在下,![]() 可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式_______,该反应中氧化产物与还原产物的物质的量之比是______。
可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式_______,该反应中氧化产物与还原产物的物质的量之比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的框架图,请回答下列问题:
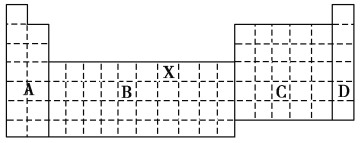
(1)写出元素X在周期表中位置___。
(2)若将此元素周期表分为A、B、C、D区,其中全部是金属元素的区域为___区。
(3)所含元素最多的周期是__,所含元素最多的族是__。
(4)硬度最大的单质是__,密度最小的金属是___。(用物质的名称填写)
(5)在原子序数为1~18号元素中,请用化学式填写。
与水反应最剧烈的金属元素是__;与酸、碱都反应的金属是__;最高价氧化物对应水化物酸性最强的酸是__;具有四核18个电子且含有非极性键的一种化合物是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z四种主族元素的单质在常温下都是气体,X、Y、Z对应的单质可以两两反应生成相应的A、B、C三个分子,其中B、C都是10电子且含有相同的元素X。A是一种难溶于水的有毒气体。他们之间还存在下列关系:
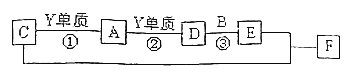
请回答下列问题:
(1)Z的原子结构示意图________,C的电子式为________。
(2)反应②的现象为______;写出反应③的化学方程式_________________________
(3)化合物F中含有的化合键为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏伽德罗常数的值,下列相关说法正确的是( )
A.2.24LN2和O2的混合气体中分子数为0.1NA
B.2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.标准状况下,22.4LCCl4中含有分子的数目为NA
D.0.1molFeCl3完全水解生成的Fe(OH)3胶体粒子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com