
【题目】(1)已知:①Fe(s)+1/2O2(g)=FeO(s) ΔH1=-272.0kJ·mol-1;
②2Al(s)+3/2O2(g)=Al2O3(s) ΔH2=-1675.7kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____(填“正”或“负”)极。F电极上的电极反应式为________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因______。


(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为____。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为___mol。
【答案】3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s) ΔH=-859.7kJ·mol-1 负 ClO-+2e-+H2O=Cl-+2OH- Mg+2H2O=Mg(OH)2+H2↑ HOOC—COOH+2e-+2H+=HOOC—CHO+H2O 2
【解析】
(1)由盖斯定律计算可得;
(2)由示意图可知,“镁﹣次氯酸盐”燃料电池中失电子的为负极,则镁合金为负极,电极反应式为Mg—2e—+2OH—=Mg(OH)2,铂合金为正极,正极上ClO﹣得电子生成氯离子,则正极的电极反应式为ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣。
(3)根据H+的移动方向可知,M电极是阳极,Cl-在阳极上发生失电子的氧化反应生成Cl2,电极反应式为2Cl--2e-=Cl2↑,N电极为阴极,HOOC-COOH在阴极上得电子发生还原反应生成HOOC-CHO,电极反应式为HOOC-COOH+2e-+2H+=HOOC-CHO+H2O。
(1)依据盖斯定律计算②-①×3得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol;故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol;
(2)①由示意图可知,“镁﹣次氯酸盐”燃料电池中,E为镁合金,为燃料电池的负极,F为铂合金,为正极,正极上ClO﹣得电子生成氯离子,则正极的电极反应式为ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣,故答案为:负;ClO-+2e-+H2O=Cl-+2OH-;
②Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O=Mg(OH)2+H2↑,故答案为:Mg+2H2O=Mg(OH)2+H2↑;
(3)①N电极为电解池的阴极,HOOC-COOH在阴极上得电子发生还原反应生成HOOC-CHO,电极反应式为HOOC-COOH+2e-+2H+=HOOC-CHO+H2O,故答案为:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O;
②2mol H+通过质子交换膜,则电池中转移2mol电子,根据电极方程式HOOC-COOH+2e-+2H+=HOOC-CHO+H2O,可知阴极生成1mol乙醛酸;阳极(M极)电极反应式为2Cl--2e-=Cl2↑,乙二醛与Cl2的反应为Cl2+OHC—CHO+H2O=HOOC—CHO+2HCl,根据题意和阴、阳极得失电子相等,阳极也生成1mol乙醛酸;由于两极均有乙醛酸生成,所以生成的乙醛酸为2mol,故答案为:2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
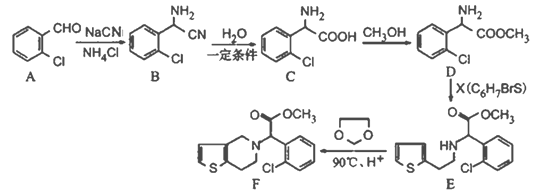
(1)写出B的分子式________________;C中碱性官能团的名称为____________________。
(2)写出与A含有相同官能团,属于芳香族化合物;且含有3种不同化学环境氢原子的同分异构体的结构简式__________________________________。
(3)C→D的反应类型是______________;X的结构简式为______________________。
(4)两个C分子可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,写出该反应的化学方程式____________________________________。
(5)已知: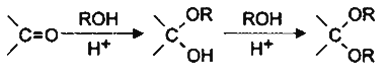
I.则由乙醇、甲醇为有机原料制备化合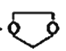 物,不需要经历下列的反应类型有____(填写编号)。
物,不需要经历下列的反应类型有____(填写编号)。
①加成反应,②消去反应,③取代反应,④氧化反应,⑤还原反应。
II.写出制备化合物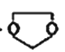 的最后一步反应的化学方程式________________________。
的最后一步反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
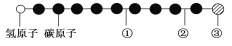
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
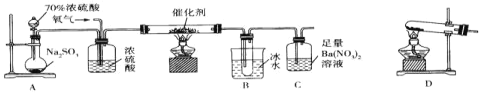
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2,并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验)。请回答下列问题:
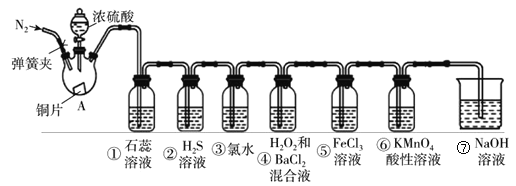
(1)在A中发生反应的化学方程式为:__________。
(2)③中化学反应方程式____,④中产生白色沉淀,离子方程式为________,⑤中的现象见溶液由黄色变为浅绿色,其反应的离子方程式为_________。
(3)能体现出SO2还原性的实验序号是____。
(4)实验结束后需要通入N2,其目的____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2![]() 2Na2FeO4+Na2O,下列说法正确的是
2Na2FeO4+Na2O,下列说法正确的是
A.Fe粉与Al2O3可以通过铝热反应制Fe2O3
B.反应中Fe2O3是还原剂
C.3molNa2O2反应,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将mg Al2O3、Fe2O3的混和物溶解在过量的100mL0.05 mol/L的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A. 0.1mol/L B. 0.05mol/L
C. 0.2mol/L D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.b为正极、a为负极 B.a为阳极、b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的框架图,请回答下列问题:
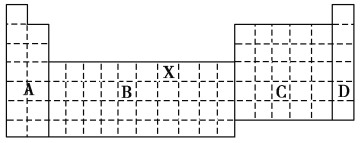
(1)写出元素X在周期表中位置___。
(2)若将此元素周期表分为A、B、C、D区,其中全部是金属元素的区域为___区。
(3)所含元素最多的周期是__,所含元素最多的族是__。
(4)硬度最大的单质是__,密度最小的金属是___。(用物质的名称填写)
(5)在原子序数为1~18号元素中,请用化学式填写。
与水反应最剧烈的金属元素是__;与酸、碱都反应的金属是__;最高价氧化物对应水化物酸性最强的酸是__;具有四核18个电子且含有非极性键的一种化合物是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com