
【题目】某厂废水中含5.00×10-3 mol·L-1的Cr2O72-,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:

(1)第①步反应的离子方程式是__________________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是________________________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有_____________________。
(4)欲使1 L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需要加入________g FeSO4·7H2O。
(5)FeSO4·7H2O晶体制备步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50 ℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
①反应时铁屑过量的目的是(用离子方程式表示) ________________________。
②溶液趁热过滤的原因是___________________________________________。
【答案】Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照 Fe(OH)3、Fe(OH)2 13.9 Fe+2Fe3+=3Fe2+ 减少FeSO4的损失;防止空气进入试管将Fe2+氧化为Fe3+
【解析】
废水中的Cr2O72-具有氧化性,在酸性条件下,与FeSO4·7H2O发生氧化还原反应生成含有Fe3+和Cr3+溶液,根据得到磁性材料Fe的化合价依次为+3、+2,因此加入的FeSO4·7H2O需要过量,形成含有Fe2+ 、Fe3+ 、Cr3+、SO42-的溶液,通过加入NaOH调节溶液的pH值用pH试纸测定溶液pH为9,在碱性条件下使Fe2+ 、Fe3+ 、Cr3+完全转化为Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀,通过过滤操作与SO42-分离,最后对Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀洗涤、干燥、焙烧,最终制得磁性材料Cr0.5Fe1.5FeO4。
(1)Cr2O72有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据得失电子、原子守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照;
(3)由题给框图之二可得:Fe2+过量,加NaOH时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀物,故答案为:Fe(OH)3、Fe(OH)2;
(4)1L废水中含n(Cr2O72-)=5.00×103mol,根据Cr原子、Fe原子守恒,可得:Cr2O72-4Cr0.5Fe1.5FeO410FeSO4·7H2O,所以理论上n(FeSO47H2O)=10n(Cr2O72-)=5.00×103mol×10=0.05mol,所以m(FeSO47H2O)=0.05mol×278g/mol=13.9g;
(5)①铁粉过量是防止亚铁离子被氧化,铁和铁离子反应重新生成亚铁离子,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
②一般物质的溶解度随温度的升高而增大,因此热溶液趁热过滤可减少硫酸亚铁晶体析出,从而减小FeSO4的损失。


科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原反应无关的是( )
A. FeCl3溶液滴入Mg(OH)2浊液,白色浊液转化为红褐色沉淀
B. AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄色褪去
C. Na放在坩埚里并加热,发生黄色火焰,生成淡黄色固体
D. H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A. AlN中氮的化合价为+3B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN的摩尔质量为41 gD. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)写出CO2和Na2O2反应的化学方程式:___________________________________。
(2)某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?__________,简要说明理由:_______________________________________________。
(3)该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
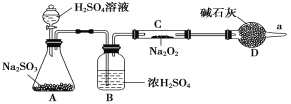
装置中B的作用是_________________,D的作用是_____________________。
(4)将足量的Na2O2投入到含有下列离子的溶液中:NO3-、S2-、HCO3-、CO32-、Na+,设反应完毕后,无固体析出,则上述离子数目减少的有__________,数目增多的离子有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol/(L·min)
B. 6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C. 反应至6 min时,c(H2O2)=0.3 mol/L
D. 反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时碳酸铵可以受热完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)现有四种有机物:①乙烯,②2-丙醇,③甲苯,④![]() ,⑤
,⑤![]() ,⑥
,⑥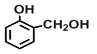 ,⑦
,⑦![]() ,⑧
,⑧![]() 其中:
其中:
(1)能衡量一个国家的石油化工生产水平的是__________(填序号),该物质可用于制备常用塑料,其反应化学方程式是_______________________。
(2)能用来制取梯恩梯(TNT)的是________(填序号),其发生反应的化学方程式是__________________;
(3)上述有机物能与金属钠发生反应的是_________(填序号),与⑧互为同分异构体的是___________(填序号),⑤与酸性高锰酸钾反应的产物是______________(填结构简式);
(二)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
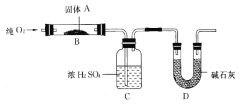
取17.1g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(4)D装置的作用是____________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________;
(5)装置改进后进行实验,若A的摩尔质量为342g/mol,C装置增重9.9g,D装置增重26.4 g,则A的分子式为_____________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com