
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160 kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=akJmol﹣1 .
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率V(NO)=;计算该反应的平衡常数K=;
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a 0(填“>”或“<”).
【答案】
(1)2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O(l)△H=﹣1910kJ/mol
(2)0.042mol?L﹣1?min﹣1,BE,降低,<
【解析】解:(1)由反应:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160 kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0 kJ/mol,由盖斯定律可知:2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O(l)△H=①+②+4×③=﹣574﹣1160﹣4×44=﹣1910kJ/mol,
所以答案是:2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O(l)△H=﹣1910kJ/mol;
(2)①0~10min内,NO的平均反应速率v(NO)= ![]() =0.042molL﹣1min﹣1;
=0.042molL﹣1min﹣1;
C(s)+2NO(g)N2(g)+CO2(g),平衡浓度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反应的平衡常数K= ![]() =
= ![]() =
= ![]() ;
;
所以答案是:0.042molL﹣1min﹣1, ![]() ;
;
②30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)N2(g)+CO2(g),依据图表数据分析,平衡状态物质浓度增大,依据平衡常数计算K= ![]() =
= ![]() =
= ![]() ,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;
,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,所以可能是减小溶液体积后加入一定量一氧化氮;
A、通人一定量的CO2,新平衡状态下物质平衡浓度增大,故正确;
B、加入合适的催化剂,催化剂只改变化学反应速率,不改变化学平衡,故错误;
C、适当缩小容器的体积,反应前后体积不变,平衡状态物质浓度增大,故正确;
D、通入一定量的NO,新平衡状态下物质平衡浓度增大,故正确;
E、加入一定量的活性炭,碳是固体对平衡无影响,平衡不动,故错误;
所以答案是:BE;
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比从为2:1:1,氮气和二氧化碳难度之比始终为1:1,所以2:1>4:3,说明平衡向逆反应方向移动,达到新平衡时NO的转化率降低,说明逆反应是吸热反应,则正反应是放热反应,所以答案是:降低;<.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征和化学平衡的计算的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温下28gN2含有的电子数为10NA
B. 标准状况下,22.4LH2O含有的分子数是NA
C. 室温下44gCO2含有的分子数是NA
D. 100mL1mol·L-1盐酸中含有的HCl分子数是0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa 下:
①2Na(s)+ ![]() O2(g)═Na2O(s)△H1=﹣414KJ/mol
O2(g)═Na2O(s)△H1=﹣414KJ/mol
②2Na(s)+O2(g)═Na2O2(s)△H2=﹣511KJ/mol
下列说法正确的是( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=﹣317kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是

A. 正反应是放热反应
B. A、B一定都是气体
C. D一定不是气体
D. C可能是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知T℃时,水的离子积为Kw,在该温度下,将a mol/L一元酸HA和b mol/L一元碱BOH等体积混合,并使混合液显中性,则必要的条件是( )
A.混合液的PH=7
B.混合液中Kw=C2(H+)
C.a=b
D.混合液满足:C(B+)+C(H+)=C(A﹣)+C(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从含有Cr2O72﹣和Cr3+的废水中回收铬的工艺流程如图所示: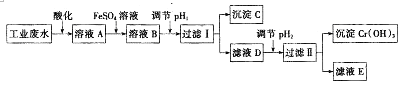
己知:①2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O;
②常温下,Ksp[(Fe(OH)3]=4.0×10﹣38;Ksp[(Cr(OH)3]=1.0×10﹣32
③当离子浓度小于1.0×10﹣5molL﹣1时,认为沉淀完全
请回答下列问题:
(1)酸化后的溶液A显色.
(2)配制FeSO4溶液时,除了加水外还需要加入的试剂是(填试剂名称).
(3)向溶液A中加入FeSO4溶液发生反应的离子方程式为 .
(4)沉淀C的化学式为 , 要使Cr3+沉淀完全pH2值至少为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJmol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:"用水银一两,白矾[KAl(SO4)2]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
(1)甘汞(Hg2Cl2)中化学键类型主要为___________.
(2)[KAl(SO4)2]所属物质类别为__________ (填标号)
A.酸式盐 B.复盐 C.正盐 D.混盐 E.硫酸盐
(3)文中“同研”涉及的操作,若在实验室通风橱内完成,则所需的仪器是_______。
(4)文中“则粉升于盆上矣”涉及的混合物分离方法是__________
(5)甘汞(Hg2Cl2)制备反应中,氧化剂与还原剂的物质的量之比为_________,该反应中还原产物是__________。
(6)已知文中一两等于十钱,则甘汞的产率约为________(保留三位有效数字)。
(7)由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能说明X的电负性比Y大的是 ( )
A. 与氢化合时X单质比Y单质容易
B. X的最高价氧化物对应水化物的酸性比Y的强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X的单质可以把Y从其氢化物中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com