
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温下28gN2含有的电子数为10NA
B. 标准状况下,22.4LH2O含有的分子数是NA
C. 室温下44gCO2含有的分子数是NA
D. 100mL1mol·L-1盐酸中含有的HCl分子数是0.1NA
【答案】C
【解析】A项,1个N2中含有14个电子;B项,H2O在标准状况下不呈气态,不能用22.4L/mol计算n(H2O);C项,n(CO2)=![]() =1mol;D项,盐酸中不含HCl分子。
=1mol;D项,盐酸中不含HCl分子。
A项,n(N2)=![]() =1mol,1个N2中含有14个电子,28gN2含电子物质的量为14mol,A项错误;B项,H2O在标准状况下不呈气态,不能用22.4L/mol计算n(H2O),B项错误;C项,n(CO2)=
=1mol,1个N2中含有14个电子,28gN2含电子物质的量为14mol,A项错误;B项,H2O在标准状况下不呈气态,不能用22.4L/mol计算n(H2O),B项错误;C项,n(CO2)=![]() =1mol,室温下44gCO2含有分子数是NA,C项正确;D项,n(HCl)=1mol/L
=1mol,室温下44gCO2含有分子数是NA,C项正确;D项,n(HCl)=1mol/L![]() 0.1L=0.1mol,HCl在水分子作用下完全电离成H+和Cl-,盐酸中不含HCl分子,D项错误;答案选C。
0.1L=0.1mol,HCl在水分子作用下完全电离成H+和Cl-,盐酸中不含HCl分子,D项错误;答案选C。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】以反应 5H2C2O4+2MnO4 -+6H+ = 10CO2↑+ 2Mn2+ + 8H2O 为例探究“外界条件对化学反应速率的影响”。实验时,分别量取 H2C2O4 溶液和酸性 KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。下列说法不正确的是

A. 实验①、 ②、 ③所加的H2C2O4 溶液均要过量
B. 实验①和实验②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响
C. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
D. 若实验①测得 KMnO4溶液的褪色时间为40s,则这段时间内平均反应速率 v(KMnO4)= 2. 5×10-4 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣870.3kJ/mol;(2)C(s)+O2(g)═CO2(g)△H2=﹣393.5kJ/mol;(3)H2(g)+ ![]() O2(g)═H2O(l)△H3=﹣285.8kJ/mol.则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
O2(g)═H2O(l)△H3=﹣285.8kJ/mol.则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的△H为( )
A.﹣488.3 kJ/mol
B.﹣244.15 kJ/mol
C.+488.3 kJ/mol
D.+244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E(C11H12O2) 属于芳香酯类物质,天然物存在于威士忌酒、苹果酒等中,呈水果及玫瑰香气,可由下列路线人工合成:

完成下列填空:
(1)A中官能团的名称是________________;C物质的结构简式是________________。
(2)反应③的条件是_______________;反应④的类型是_____________________。
(3)写出反应⑥的化学方程式:__________________________________________________________________。
(4)如何检验反应②中的A是否完全转化?__________________________________________________________________。
(5)设计一条由![]() 出发,制备
出发,制备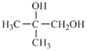 的合成路线(合成路线常用的表示方式为:
的合成路线(合成路线常用的表示方式为: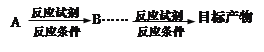 )______________________________。
)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用分别是( )
A.分子间作用力,离子键
B.化学键,分子间作用力
C.化学键,化学键
D.分子间作用力,分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中轴表示实验时流入正极的电子的物质的量, y轴表示

A. 铜棒的质量 B. c(H+) C. c(SO42-) D. c(Zn2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中提取碘单质,成熟的工艺流程如下

下列关于海水制碘的说法,正确的是
A. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B. 可用酒精萃取碘水中的I2
C. 沸水浸泡海带灰的目的是为了加快I-的溶解,并使之溶解更充分
D. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160 kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=akJmol﹣1 .
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率V(NO)=;计算该反应的平衡常数K=;
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a 0(填“>”或“<”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com