
【题目】I.氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:

当Cl2与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为____kJ.
(2)在一个恒容密闭容器中究入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
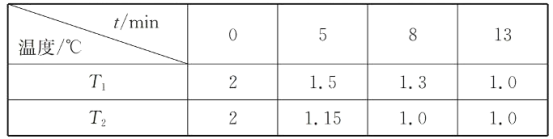
①T1________T2(填“>“”<”或”=”)。
②温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示
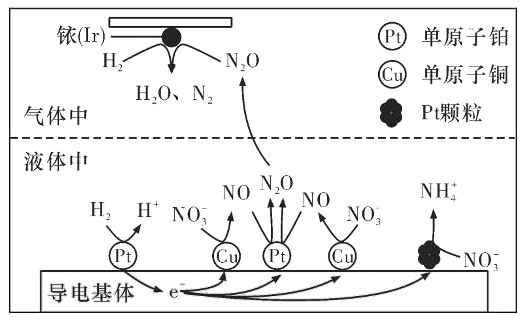
①Ir表面发生反应的方程式为_____________。
②若导电基体上的Pt颗粒增多,造成的后果是______________。
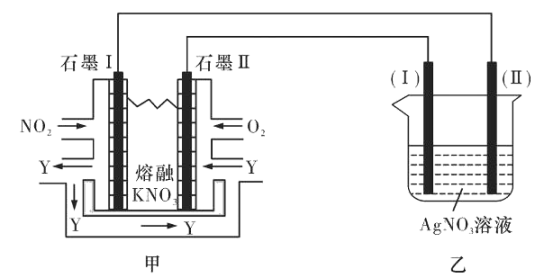
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
 请回答下列问题:
请回答下列问题:
(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为________。
②若用10A的电流电解60min后,乙中阴极得到32.4gAg,则该电解池的电解效率为____%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol)
【答案】277.5 < ![]() H2+N2O
H2+N2O![]() N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 80.4
N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 80.4
【解析】
(1)2NO(g)+Cl2(g)![]() 2ClNO(g),反应的焓变△H=反应物总键能-生成物总键能,据此计算;
2ClNO(g),反应的焓变△H=反应物总键能-生成物总键能,据此计算;
(2)①温度越高,反应速率越大,达到平衡状态所需要的时间短;
②用三段式法计算出平衡时各种成分的物质的量,根据压强比等于气体的物质的量的比,用每种物质的物质的量占总物质的量的百分比乘以总压强得该组分的分压,带入平衡常数表达式,可得Kp;
(3)①由原理的示意图可知,Ir的表面氢气和N2O发生反应生成N2和H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根。
(4)①石墨I上发生氧化反应,为原电池的负极,石墨II为原电池的正极,正极上发生还原反应;
②根据Ag的质量计算电子转移的物质的量,结合法拉第常数为96500C/mol及电流强度与通电时间可计算出电解池的电解效率。
(1)2NO(g)+Cl2(g)![]() 2ClNO(g),1molCl2参与反应发生焓变△H=243kJ/mol+2×630kJ/mol-2×(200kJ/mol+607kJ/mol)=-111kJ/mol,此时转移2mol电子,则有5mol电子转移时,热量变化为111kJ/mol×
2ClNO(g),1molCl2参与反应发生焓变△H=243kJ/mol+2×630kJ/mol-2×(200kJ/mol+607kJ/mol)=-111kJ/mol,此时转移2mol电子,则有5mol电子转移时,热量变化为111kJ/mol×![]() mol=277.5kJ;
mol=277.5kJ;
(2)①温度越高,反应速率越大,达到平衡状态所需要的时间短,根据表格数据可知在温度为T2时先达到平衡,所以反应温度T1<T2;
②起始物质的量为3mol,压强为p0,反应后各物质变化为
2NO+Cl2![]() 2ClNO
2ClNO
起始物质的量 2 1 0
达平衡物质的量 1 0.5 1
在恒容密闭容器中发生反应,气体的物质的量的比等于压强之比,反应后气体的总物质的量n(总)后=2.5mol,反应前气体的物质的量n(前)总=3mol,所以反应后压强为P=![]() P0=
P0=![]() P0;p(NO)=p(ClNO)=
P0;p(NO)=p(ClNO)=![]() ×
×![]() P0=
P0=![]() P0;p(Cl2)=
P0;p(Cl2)=![]() p(NO)=
p(NO)=![]() P0,则化学平衡常数Kp=
P0,则化学平衡常数Kp= =
=![]() ;
;
(3)①在Ir表面上H2与N2O反应产生N2和水,反应方程式为H2+N2O![]() N2+H2O;
N2+H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根,不利于降低溶液中含氮量;
(4)①根据图示可知在石墨I上NO2失去电子发生氧化反应转化为N2O5,为原电池的负极,石墨II上O2获得电子,与溶液中的N2O5结合形成NO3-,发生还原反应,为原电池的正极,电极反应式为:O2+4e-+2N2O5=4NO3-;
②n(Ag)=![]() =0.3mol,由于每反应产生1molAg,转移1mol电子,则转移的电量为Q=0.3mol×96500C/mol=28950C,由于电流强度为10A,电解时间为60min,转移的总电量Q总=10×60×60C=36000C,所以电解池的电解效率=
=0.3mol,由于每反应产生1molAg,转移1mol电子,则转移的电量为Q=0.3mol×96500C/mol=28950C,由于电流强度为10A,电解时间为60min,转移的总电量Q总=10×60×60C=36000C,所以电解池的电解效率=![]() ×100%=80.4%。
×100%=80.4%。


科目:高中化学 来源: 题型:
【题目】某温度下,浓度都是1mol·L-1的两种气体X2和Y2在密闭容器中反应,经过tmin后,测得物质的浓度分别为:c(X2)=0.4mol·L-1,c(Y2)=0.8mol·L-1,则该反应的方程式可表示为()
A. X2+2Y2![]() 2XY2B. 2X2+Y2
2XY2B. 2X2+Y2![]() 2X2Y
2X2Y
C. X2+3Y2![]() 2XY3D. 3X2+Y2
2XY3D. 3X2+Y2![]() 2X3Y
2X3Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色酮类化合物K具有抗菌、降血脂等生理活性,其合成路线如图:

已知:① +HCl(R代表烃基)
+HCl(R代表烃基)
②![]() +R’OH
+R’OH![]() +RCOOH(R、R’代表烃基)
+RCOOH(R、R’代表烃基)
③ (R、R1、R2、R3、R4代表烃基)
(R、R1、R2、R3、R4代表烃基)
(1)A的结构简式是__;根据系统命名法,F的名称是__。
(2)B→C所需试剂a是__;试剂b的结构简式是__。
(3)C与足量的NaOH反应的化学方程式为__。
(4)G与新制Cu(OH)2反应的化学方程式为__。
(5)已知:①2H![]() J+H2O;②J的核磁共振氢谱只有两组峰。
J+H2O;②J的核磁共振氢谱只有两组峰。
以E和J为原料合成K分为三步反应,写出有关化合物的结构简式:

E:__;J:__;中间产物2:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某学生用98%的浓硫酸(密度为1.84 g/cm3)配制100 mL1mol/L的稀硫酸。其实验过程如下:
①该学生所用的98%的浓硫酸(密度为1.84 g/cm3)的物质的量浓度为_______;
②配制稀硫酸时所需要浓硫酸体积为_______mL,用_______量筒(“100 mL”或 “10 mL”)量取浓硫酸;
③将量取的浓硫酸沿烧杯内壁慢慢注入盛有约20mL水的烧杯里,并不断搅拌;
④将____________的上述溶液沿玻璃棒注入100 mL的容量瓶中,并用50mL蒸馏水分2~3次洗涤烧杯,洗涤液也注入容量瓶中,并摇匀;
⑤加水至距刻度线1~2cm时,改用_____________加水,使溶液凹液面跟刻度相平。
(2)该学生通过查阅资料可知,溶液的浓度还可用体积比法表示,如:1:10的硫酸就是将1体积的浓硫酸与10体积的水混合,计算体积比为1:10的硫酸的溶质质量分数为__________(列出计算式即可)。(已知:浓硫酸的质量分数为98%,密度为1.84 g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法中正确的是
A.2.4g金属镁变成镁离子时失去的电子数为0.1NA
B.标况下,mg气体A与ng气体B的分子数相同,则A、B两气体的密度之比为n∶m
C.含有NA个氦原子的氦气的体积约为11.2L
D.1.7gOH-中所含的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列判断正确的是( )
A.22.4L氯气中含有的Cl数目为2NA
B.1.0mol/LCaCl2溶液中含有的Cl-数目为2NA
C.7.8gNa2O2晶体中含有的Na+数目为0.1NA
D.2.0g重水(2H216O)中含有的中子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。0.05mol某烃完全燃烧后,测得生成的二氧化碳为5.6L(STP)、生成的水为5.4g。请通过计推导该烃的分子式,并写出它可能的结构简式及对应的名称。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com