
| A. | 2H++2e-═H2 | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe+2e-═Fe2+ |
科目:高中化学 来源: 题型:解答题

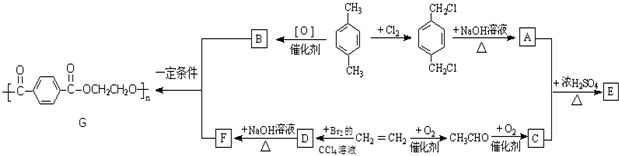
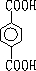
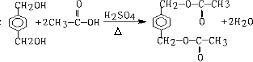
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -8Q kJ•mol-1 | B. | +16Q kJ•mol-1 | C. | +8Q kJ•mol-1 | D. | -16Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温pH=3的硫酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 | |
| B. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒能凝聚水中的悬浮物 | |
| C. | 除去MgCl2溶液中的FeCl3,可向其中加入MgCO3 | |
| D. | 除去锅炉水垢中的CaSO4,可加入Na2CO3溶液将其转化为CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
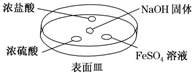
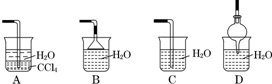


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
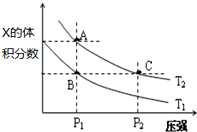 t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
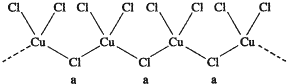 铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO). 杂化轨道类型sp2
杂化轨道类型sp2 杂化轨道类型sp3.
杂化轨道类型sp3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
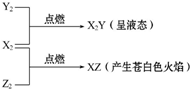 常温、常压下X2、Y2、Z2三种气体有如图转化关系:
常温、常压下X2、Y2、Z2三种气体有如图转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com