
����Ŀ�����ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ�������ش��������⣺ 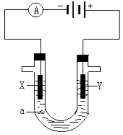
��1����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��ʵ�鿪ʼʱ��ͬʱ������ �����뼸�η�̪��Һ���� X�������۲쵽�������ǣ�
��2��Y�缫�ϵĵ缫��Ӧʽ�� �� ����õ缫��Ӧ����ķ����ǣ�
��3������õ�ⷽ��������ͭ����ͭ�к�������п�����������Һaѡ��CuSO4��Һ����Y �缫�IJ����� �� �缫��Ӧʽ�� ��
���𰸡�
��1��������,��Һ���
��2��2Cl����2e��=Cl2������ʪ��ĵ��۵⻯����ֽ�ӽ�������,�����ֽ����ɫ��˵����������
��3����ͭ�� Zn��2e�TZn2+,Cu��2e���TCu2+
���������⣺��1���͵�Դ�ĸ��������ĵ缫X�����������õ缫�������ӷ����õ��ӵĻ�ԭ��Ӧ����2H++2e��=H2����������Χ�������������������ӣ����Եη�̪��Һ��죬���������ݲ�������Һ��죬���Դ��ǣ������ݣ���Һ��죻��2����X��Y���Ƕ��Ե缫��a�DZ���NaCl��Һ��Y�缫�������ӷŵ������������缫��ӦʽΪ2Cl����2e��=Cl2�����������������ԣ����������������ɵⵥ�ʣ�����������Һ����ɫ����������������ʪ��ĵ��۵⻯����ֽ���飬
���Դ��ǣ�2Cl����2e��=Cl2������ʪ��ĵ��۵⻯����ֽ�ӽ������ڣ������ֽ����ɫ��˵��������������3����Ҫ�õ�ⷽ��������ͭ�����Һaѡ��CuSO4��Һ������Ӧ���Ǵ�ͭ�������Ǵ�ͭ����X�缫�Ǵ�ͭ��Y�缫�Ǵ�ͭ�������缫��Ӧʽ��Zn��2e�TZn2+��Cu��2e���TCu2+��������ͭ���ӷŵ磬�缫��ӦʽΪCu2++2e��=Cu��
���Դ��ǣ���ͭ��Zn��2e�TZn2+��Cu��2e���TCu2+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ģ�ij�о�С���Ʊ��������Բ�����������������̽����
��1��װ��A����MnO2��Ũ���ᷴӦ��ȡCl2��������ŨHCl��______��������������������ԭ��������
��2��A�в��������岻�������е����ʿ�����______��
��3��B�����ռ�Cl2��������װ��B���ü�ͷ�����������巽��____________
��4��C�������ն����Cl2��C�з�����Ӧ�����ӷ���ʽ��______��
��5����С�����о������Ũ�ȶ���Cl2��Ӱ�죬���ʵ���������̽����
ʵ�� | ���� | ���� |
I | �����½�MnO2��12 mol��L��1Ũ������ | ��Һ��dz��ɫ�����д̼�����ζ |
II | ��I�л������ˣ�������Һ | ���ɴ�������ɫ���� |
III | ����MnO2��4 mol��L��1ϡ�������� | ���������� |
����֪MnO2�������ԡ�I����Һ��dz��ɫ������MnO2��Ũ���ᷢ���˸��ֽⷴӦ����ѧ����ʽ��________��
��II�з����˷ֽⷴӦ����Ӧ�Ļ�ѧ����ʽ��________��
��III�������������ԭ������c(H+)��c(Cl��)�ϵͣ����ʵ��IV����̽����
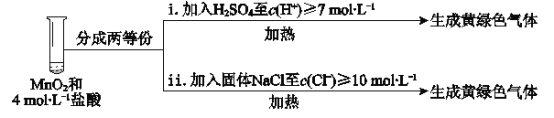
��ʵ��III��IV���Աȣ��ó��Ľ�����________����i��ii���Աȣ��ó��Ľ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���黯��(GaAs)�������İ뵼����ϻ����������ͼ�������̫���ܵ�صIJ��ϵȡ�����Ԫ�������ڱ���λ������:
A1 | Si | P |
Ga | Ge | As |
�ش���������:
��1������Ԫ���У��ǽ�������ǿ��Ԫ����:________.д��Asԭ�ӵ������ĵ����Ų�ʽ_________,Asԭ�Ӻ�����_____��δ�ɶԵ��ӡ�
��2������Ԫ�������ɣ����ж�ԭ�Ӱ뾶Ga_____As��(ѡ�>������<����=��)��д����������������Ӧˮ����ĵ��뷽��ʽ:________________
��3��NH3�ķ��ӹ�����_______��GaF3���۵����1000��C,GaCl3���۵�Ϊ77.9��C,���ܵ�ԭ����_______.д��C2H2�ĵ���ʽΪ:_________
��4���Ƚ�������±������۵�ͷе㣬������仯���ɼ�ԭ��___________
GeCl4 | GeBr4 | GeI4 | |
�۵�/��C | -49.5 | 26 | 146 |
�е�/��C | 83.1 | 186 | Լ400 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ԭ��ص������͵��ص������������ķ�Ӧ�ֱ��ǣ� ��
A����������ԭ B����ԭ������
C������������ D����ԭ����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z ���ǽ������� X ���� Z ����������Һ�У�X �ı����� Z ������X �� Y ���ԭ���ʱ��Y Ϊ��صĸ�����X��Y��Z ���ֽ����Ļ��˳��Ϊ( )
A.X>Y>ZB.X>Z>YC.Y>X>ZD.Y>Z>X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦA2�� B2�� 2AB�������仯��ͼ��ʾ��������˵����ȷ����( )

A. �÷�Ӧ�����ȷ�Ӧ
B. ����1 mol A��A����1 mol B��B���ܷų�x kJ������
C. ����2 mol A��B����Ҫ����y kJ������
D. 2 mol AB������������1 mol A2��1 mol B2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M(����ʽ��C6H4S4)�����ηɻ����������ϵ���Ҫ�ɷ֡�ij��ѧ��ȤС��Ϊ��֤�����Ԫ�أ���̽������ӽṹ����������ʵ�飺
(1)��֤���Ԫ��
��������Ʒ����ȼ�չ�A�У�ͨ������O2���õ�¯����ʹ����ȼ�գ�����ȼ�ղ�������ͨ������װ�á�(�г�������װ������ȥ)
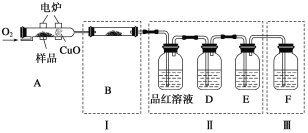
��д��A����Ʒȼ�յĻ�ѧ����ʽ��_____________________________________��
��װ��B��Ŀ������֤�л����к���Ԫ�أ���B��ʢװ���Լ�Ϊ________________��
��D��ʢ�ŵ��Լ���_________________(�����)��
a��NaOH��Һ�� b��Ʒ����Һ�� c������KMnO4��Һ d.����ʯ��ˮ
����֤���л��ﺬ̼Ԫ�ص�������_________________��
��װ�â��ܻ�����������___________________��
��ȼ�չ��з���CuO��������_______________________��
��ָ��װ��F�Ĵ���____________________________��
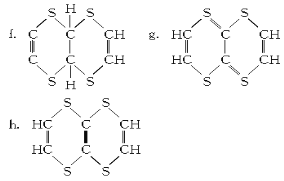
(2)̽���л���M�ķ��ӽṹ�߶ȶԳƣ���ԭ�ӵĻ�������ͬ����2.04 g���л���������CCl4��Һ���������Һ��ɫ����������0.03 mol Br2��
����л�����ӽṹ�к��еĹ�����Ϊ___________________(��ṹʽ)��
���л���M�Ľṹ��ʽΪ_________________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��ԭ���������ȷ����
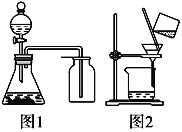
A. ѡ����ʵ��Լ�����ͼ1��ʾװ�ÿɷֱ���ȡ����CO2��NO��O2
B. ��ȥ����CO2�л��е�����SO2���ɽ������������ͨ��ʢ����������KMnO4��Һ��Ũ�����ϴ��ƿ
C. ϴ�ӳ���ʱ(��ͼ2)����©���м�����ˮ�����貢�˸�
D. ����ˮ�����Һ©�����������Ҵ������ã��ɽ�����ȡ���Ҵ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com