
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁
性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出
现血红色.
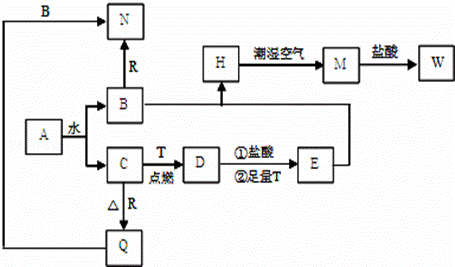
(1)写出下列物质的化学式:D: E: N: .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象:
(3)按要求写方程式:
B和R反应生成N的离子方式: ;
M→W的离子方程式: .
科目:高中化学 来源: 题型:
化合物与NaOH溶液、碘水三者混合可发生如下反应:
(1)I2 + 2NaOH == NaI + NaIO + H2O (2)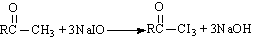
(3)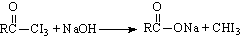 ,此反应称为碘仿反应。根据上述反应方程式,推断下列物质中能发生碘仿反应的有
,此反应称为碘仿反应。根据上述反应方程式,推断下列物质中能发生碘仿反应的有
A.CH3CHO B.CH3CH2CHO
C.CH3CH2COCH2CH3 D.CH3COCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.HCl的相对分子质量与6.02×1023个HCl分子的质量(以g为单位)在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为( )
A.-82kJ/mol B.-41kJ/mol C.-312kJ/mol D.+82kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述
反应 PCl3(g)+Cl2(g)=PCl5(g),达平衡时,PCl5为0.40mol,如果此时移走
1.0molPCl3 和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B.小于0.20mol
C.0.20mol D.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
①可以燃烧; ②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应; ④能发生酯化反应;
⑤能发生加聚反应; ⑥能发生水解反应
A.①④ B.只有⑥ C.只有⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于改变条件对活化分子影响的说法错误的是
A.温度不变时,增大反应物浓度可能增大活化分子的分子数
B.其他条件不变时,升高温度能使分子获得更高的能量,活化分子百分数提高
C.其他条件不变时,对于有气体参与和生成的反应而言,缩小体积增大体系
的压强能增大单位体积内的活化分子百分数
D.其他条件不变时,加人正催化剂能提高反应体系中含有的活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
I、回答下列问题
1)、已知常温下,在NaHSO3溶液中c(H2SO3 ) < c(SO32 -) ,且H2SO3 的电离平衡常数为K1=1.5×10-2 K2=1.1×10-7 ;氨水的电离平衡常数为K=1.8×10-2 ;
则等物质的量浓度的下列五种溶液:①NH3·H2O ②(NH4)2CO3 ③KHSO3 ④KHCO3 ⑤Ba(OH)2,溶液中水的电离程度由大到小排列顺序为_____________
2)、NaHSO3具有较强还原性可以将碘盐中的KIO3氧化为单质碘,试写出此反应的离子反应方程式_______________________________________
3)、在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是_________________,用离子方程式表示产生上述现象的原因:__________________
II、已知25 ℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33
(1)①在25 ℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②用MgCl2、AlCl3的混合溶液(A) 与过量氨水(B) 反应,为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入________(填“A”或“B”),再滴加另一反应物。
(2)溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。请写出计算过程_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com