
 xC(g) ЎчHЈј0ЎЈІвөГБҪИЭЖчЦРc(A)ЛжКұјдtөДұд»ҜИзНјЛщКҫЈә
xC(g) ЎчHЈј0ЎЈІвөГБҪИЭЖчЦРc(A)ЛжКұјдtөДұд»ҜИзНјЛщКҫЈә
| ИЭЖч | јЧ | ТТ |
| ИЭ»эЈЁLЈ© | 0.5 | 0.5 |
| ·ҙУҰ·ЕИИЈЁkJЈ© | Q1 | Q2 |
| ·ҙУҰОпЖрКјБҝ | 1 molA 1 molB | 0.5 molA 0.5 molB |


 ЖЯІКМвҝЁҝЪЛгУҰУГТ»өгНЁПөБРҙр°ё
ЖЯІКМвҝЁҝЪЛгУҰУГТ»өгНЁПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 cC(g) + dD(g)Ј¬·ҙУҰ№эіМЦРЈ¬өұЖдЛьМхјюІ»ұдКұЈ¬CөД°Щ·Цә¬БҝЈЁC%Ј©УлОВ¶ИЈЁTЈ©әНС№ЗҝЈЁPЈ©өД№ШПөИзНјПВБРРрКцХэИ·өДКЗ
cC(g) + dD(g)Ј¬·ҙУҰ№эіМЦРЈ¬өұЖдЛьМхјюІ»ұдКұЈ¬CөД°Щ·Цә¬БҝЈЁC%Ј©УлОВ¶ИЈЁTЈ©әНС№ЗҝЈЁPЈ©өД№ШПөИзНјПВБРРрКцХэИ·өДКЗ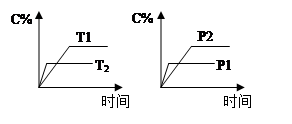
| AЈ®ҙпЖҪәвәуЈ¬ИфЙэОВЈ¬ЖҪәвЧуТЖ |
| BЈ®ҙпЖҪәвәуЈ¬јУИлҙЯ»ҜјБФтC%Фцҙу |
| CЈ®»ҜС§·ҪіМКҪЦРa+bЈҫc+d |
| DЈ®ҙпЖҪәвәуЈ¬јхЙЩAөДБҝУРАыУЪЖҪәвПтУТТЖ¶Ҝ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2Z(g)өДЖҪәвіЈКэОӘ1 600ЎЈҙЛОВ¶ИПВЈ¬ФЪИЭ»эТ»¶ЁөДГЬұХИЭЖчЦРјУИлТ»¶ЁБҝөДXәНYЈ¬·ҙУҰөҪДіКұҝМІвөГёчЧй·ЦөДЕЁ¶ИИзПВЈә
2Z(g)өДЖҪәвіЈКэОӘ1 600ЎЈҙЛОВ¶ИПВЈ¬ФЪИЭ»эТ»¶ЁөДГЬұХИЭЖчЦРјУИлТ»¶ЁБҝөДXәНYЈ¬·ҙУҰөҪДіКұҝМІвөГёчЧй·ЦөДЕЁ¶ИИзПВЈә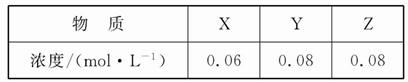
| AЈ®ҙЛКұv(Хэ)Јјv(Дж) |
| BЈ®ЖҪәвКұYөДЕЁ¶ИОӘ0.05 molЎӨL-1 |
| CЈ®ЖҪәвКұXөДЧӘ»ҜВКОӘ40% |
| DЈ®ФцҙуС№ЗҝК№ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ЖҪәвіЈКэФцҙу |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2H2(g)+S2(g)
2H2(g)+S2(g)  HЈҫ0Ј¬І»ёДұдЖдЛыМхјюөДЗйҝцПВәПАнөДЛө·ЁКЗ
HЈҫ0Ј¬І»ёДұдЖдЛыМхјюөДЗйҝцПВәПАнөДЛө·ЁКЗAЈ®јУИлҙЯ»ҜјБЈ¬·ҙУҰНҫҫ¶Ҫ«·ўЙъёДұдЈ¬ HТІҪ«ЛжЦ®ёДұд HТІҪ«ЛжЦ®ёДұд |
| BЈ®ЙэёЯОВ¶ИЈ¬ХэДж·ҙУҰЛЩВК¶јФцҙуЈ¬H2S·ЦҪвВКТІФцҙу |
| CЈ®ФцҙуС№ЗҝЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬Ҫ«ТэЖрМеПөОВ¶ИҪөөН |
| DЈ®ИфМеПөәгИЭЈ¬ЧўИЛТ»Р©H2әуҙпРВЖҪәвЈ¬H2ЕЁ¶ИҪ«јхРЎ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 A2(g) Ј«B2(g),І»ДЬИ·¶ЁҙпөҪЖҪәвЧҙМ¬өДКЗ
A2(g) Ј«B2(g),І»ДЬИ·¶ЁҙпөҪЖҪәвЧҙМ¬өДКЗ| AЈ®өҘО»КұјдДЪЙъіЙn mol A2Ј¬Н¬КұЙъіЙ2n molAB |
| BЈ®өҘО»КұјдДЪЙъіЙn mol B2Ј¬Н¬КұЙъіЙ2n molAB |
| CЈ®ABөДПыәДЛЩВКөИУЪA2өДПыәДЛЩВК |
| DЈ®ИЭЖчЦРёчЧй·ЦөДОпЦКөДБҝ·ЦКэІ»ЛжКұјдұд»Ҝ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 Cl2(g)Ј«CO(g)Ј¬Пт2.0 LәгИЭГЬұХИЭЖчЦРідИл
Cl2(g)Ј«CO(g)Ј¬Пт2.0 LәгИЭГЬұХИЭЖчЦРідИл| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 nY(g) ЎчHЈҪQ kJЎӨmol-1Ј»·ҙУҰҙпөҪЖҪәвКұЈ¬XөДОпЦКөДБҝЕЁ¶ИУлОВ¶ИЎўЖшМеМе»эөД№ШПөИзПВұнЛщКҫЈә
nY(g) ЎчHЈҪQ kJЎӨmol-1Ј»·ҙУҰҙпөҪЖҪәвКұЈ¬XөДОпЦКөДБҝЕЁ¶ИУлОВ¶ИЎўЖшМеМе»эөД№ШПөИзПВұнЛщКҫЈә| ИЭЖчМе»э/L c(X)/molЎӨLЎӘ1 ОВ¶И/Ўж | 1 | 2 | 3 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0. 90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2NH3(g) ЎчHЈҪЈӯ92.4 kJЎӨmol-1ЎЈәгИЭКұЈ¬ МеПөЦРёчОпЦКЕЁ¶ИЛжКұјдұд»ҜөДЗъПЯИзНјКҫЎЈПВБРЛө·ЁІ»ХэИ·өДКЗЈЁ Ј©
2NH3(g) ЎчHЈҪЈӯ92.4 kJЎӨmol-1ЎЈәгИЭКұЈ¬ МеПөЦРёчОпЦКЕЁ¶ИЛжКұјдұд»ҜөДЗъПЯИзНјКҫЎЈПВБРЛө·ЁІ»ХэИ·өДКЗЈЁ Ј©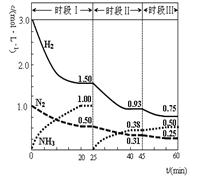
| AЈ®З°20·ЦЦУ·ҙУҰДЪ·ЕіцөДИИБҝОӘ46.2kJ |
| BЈ®өЪ25·ЦЦУёДұдөДМхјюКЗҪ«NH3ҙУ·ҙУҰМеПөЦР·ЦАліцИҘ |
| CЈ®ИфөЪ60·ЦЦУКұ·ҙУҰУЦҙпөҪБЛЖҪәвЈ¬ФтКұ¶ОўуёДұдөДМхјюКЗҪөөНОВ¶И |
| DЈ®Кұ¶ОўсҪцҪ«іхКјН¶·ЕөДОпЦКЕЁ¶ИФцЦБФӯАҙөД2ұ¶,Фт·ҙУҰОпөДЧӘ»ҜВКФцҙу,ЖҪәвіЈКэІ»ұд |
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com