
| A. | 高锰酸钾酸性溶液与草酸钾溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | KI的酸性溶液长期置于空气中::4I-+4H++O2═2I2+2H2O | |
| C. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O | |
| D. | 用食醋除去水垢:CO32-+2CH3COOH═H2O+CO2↑+2CH3COO- |
分析 A.酸性高锰酸钾溶液具有强氧化性,能够将草酸根离子氧化成二氧化碳气体;
B.碘离子具有较强还原性,能够被空气中氧气氧化;
C.酸性条件下S2O32-与氢离子反应生成硫单质、二氧化硫气体和水;
D.碳酸钙为难溶物,离子方程式中碳酸钙不能拆开.
解答 解:A.高锰酸钾酸性溶液与草酸钾溶液发生氧化还原反应,反应的离子方程式为:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,故A正确;
B.KI的酸性溶液长期置于空气中,碘离子被氧气氧化成碘单质,反应的离子方程式为:4I-+4H++O2═2I2+2H2O,故B正确;
C.硫代硫酸钠溶液中滴加稀硫酸,反应的离子方程式为:2H++S2O32-═S↓+SO2↑+H2O,故C正确;
D.碳酸钙和醋酸都需要保留化学式,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故D错误;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸 | |
| D. | 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HF | HClO | H2CO3 |
| 电离平衡常数 | 6.8×10-9 | 4.7×10-15 | K1=4.4×10-7 K2=4.7×10-11 |
| A. | 常温下,同物质的量浓度的HF与H2CO3溶液,前者的c(H+)较小 | |
| B. | 若某溶液中c(F-)=c(ClO-),往该溶液中滴入HCl,F-比ClO-更易结合H+ | |
| C. | 往饱和Na2CO3溶液中逐滴加入稀盐酸至过量,所得溶液中c(HCO3-)先增大后减小 | |
| D. | 同温下,等体积、等c(H+)的HF和HClO分别与NaOH完全反应,消耗等量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$\stackrel{O_{2}催化剂}{→}$NO$\stackrel{O_{1}和H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 制取Mg:海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
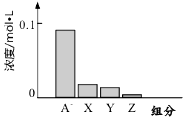 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com