
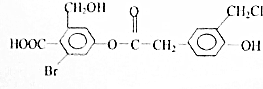 有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )| A. | 8:1:7 | B. | 5:1:6 | C. | 5:2:6 | D. | 7:1:6 |
分析 该有机物中含有酚羟基、醇羟基、所记哦、酯基以及-Br、-Cl等官能团,-OH、-COOH能和Na反应,酯基、酚羟基-Br、-Cl和-COOH能和NaOH反应,只有-COOH能和NaHCO3反应,只有苯环与氢气发生加成反应,以此解答该题.
解答 解:有机物含有1个羧基,1个酚羟基,1个酯基,且酯基可水解生成羧基和酚羟基,-Br可水解生成酚羟基和HBr,且-Cl也可在碱性条件下水解,则1mol有机物可与7molNaOH;
只有羧基于碳酸氢钠反应,则1mol有机物可与1mol碳酸氢钠反应;
能与氢气反应的苯环,则1mol有机物可与6mol氢气发生加成反应,
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、酚、羧酸的性质,注意酚羟基和碳酸氢钠不反应,但和碳酸钠反应,为易错点.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
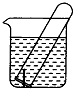 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| ① | 将Fe投入硫酸铜溶液中; | 验证Fe的金属性比Cu强. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅④ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Te原子的相对原子质量是127.5 | |
| B. | Te元素可能会有多种同位素 | |
| C. | Te原子5p亚层有2对成对电子 | |
| D. | Te原子最外层有6个运动状态相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 选项 | 甲 | 乙 | 丙 | 试管中现象 |
| A | 浓氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 浓硝酸 | 铜 | 淀粉KI溶液 | 试管口出现红棕色溶液仍为无色 |
| C | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
| D | 双氧水 | 二氧化锰 | 氢硫酸 | 溶液出现浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液中:Fe3+、NH4+、Cl-、N03- | |
| B. | 水电离出的c(H+)=$\sqrt{{k}_{w}}$的溶液中:Na+、S042-、C032-、K+ | |
| C. | 由水电离的c(OH-)=1×10-2mol•L-1的溶液中:Cl-、CH3COO-、K+、AlO2- | |
| D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、N03-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾在水中形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 氧化铝常被用于制作作耐火材料 | |
| C. | Fe2O3俗称铁红,常用作红色的油漆和涂料 | |
| D. | Na2O2具有强氧化性,不能用作呼吸面具中的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com