
分析 (1)根据氧化还原反应中得失电子守恒来计算,n(Cr2O72-)×6=n(FeSO4•7H2O)×1;
(2)每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒分析配平书写氧化还原反应的离子方程式;
(3)根据Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3,来计算铬离子的浓度是否小于10-5mol/L;
(4)用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,生成的亚铁离子与Cr2O72-发生氧化还原反应被还原为Cr3+然后生成Cr(OH)3沉淀除去;
(5)阴极氢离子得电子生成氢气,所以溶液pH升高,同时生成铁离子也转化为氢氧化铁沉淀;
(6)根据Q=It和n=$\frac{Q}{F}$结合除去1molNa2Cr2O7需6mol电子解答.
解答 解:(1)根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4•7H2O)×1,n(FeSO4•7H2O)=$\frac{1mol×6}{1}$=6mol,
故答案为:6;
(2)每消耗0.1mol Na2S2O3转移0.8mol e-,Na2S2O3 ~2SO42-~8e-,Cr2O72-~2Cr3+~6e-,依据氧化还原反应电子守恒配平书写,3Na2S2O3 ~6SO42-~24e-,4Cr2O72-~8Cr3+~24e-,得到的氧化还原反应的离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(3)pH=5时,C(OH-)=10-9mol/L,Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3=c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5,所以没有沉淀完全,
故答案为:Ksp[Cr(OH)3]=c(Cr3+)•(OH-)3=c(Cr3+)•(10-9)3=6.3×10-31,解之得c(Cr3+)=6.3×10-4>10-5,所以没有沉淀完全;
(4)用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,生成的亚铁离子与Cr2O72-发生氧化还原反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,被还原为Cr3+生成Cr(OH)3沉淀除去,所以阳极区的总反应方程式为:Cr2O72-+6Fe-12e-+14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe-12e-+14H+=2Cr3++6Fe3++7H2O;
(5)阴极氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,同时生成铁离子也转化为氢氧化铁沉淀,
故答案为:2H++2e-=H2↑;Fe(OH)3;
(6)Q=It=0.5A×5×60s=150C,n=$\frac{Q}{F}$=$\frac{150}{96500}$mol,除去1molNa2Cr2O7需6mol电子,理论上除去Na2Cr2O7的物质的量为:$\frac{150}{\frac{96500}{6}}$mol≈0.009mol,
故答案为:0.009.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,题目难度中等,抓住题目信息是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 工业上可用Cl2制造漂白粉 | B. | MgO 常用作耐高温材料 | ||
| C. | NaCl用于金属钠的冶炼 | D. | Na2CO3是发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂 | B. | 酸化剂 | C. | 还原剂 | D. | 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用苯萃取溴水时有机层应从下口放出 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
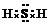 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
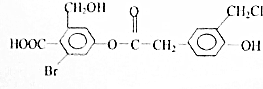 有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )| A. | 8:1:7 | B. | 5:1:6 | C. | 5:2:6 | D. | 7:1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )
现代无机化学队硫-氮化合物的研究是最为活跃的领域之一,其中如图所示是已经合成的最著名的硫-氮化合物的分子结构式,下列说法不正确的是( )| A. | 该物质的分子式为S4N4 | |
| B. | 该物质的分子中既有极性键又有非极性键 | |
| C. | 该物质的分子中N、S原子均采取sp3杂化 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com