
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构。则下列有关说法中错误的是( )
A. 1 mol NH5中含有5NA个N—H键(NA表示阿伏伽德罗常数的值)
B. NH5中既有共价键又有离子键
C. NH5的电子式为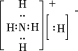
D. 它与水反应的化学方程式为NH5 +H2O===NH3·H2O+H2↑
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器里进行反应,M、N的物质的量随时间的变化曲线如图所示,且两者都为气体:
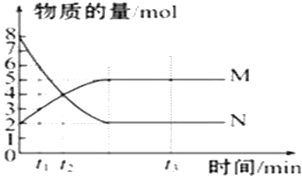
(1)此反应的化学方程式为__________________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:__________________。
(3)达平衡时N的转化率为:_______________ ;
(4)反应前与达平衡时容器内压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
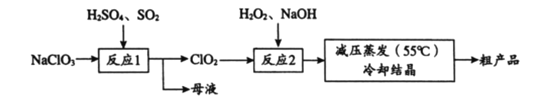
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯利(C2H6ClO3P)能释放出乙烯从而促进果实成熟,可由环氧乙烷![]() 和PCl3为原料合成。下列说法正确的是( )
和PCl3为原料合成。下列说法正确的是( )
A. 乙烯利、环氧乙烷均属于烃
B. PCl3分子中P原子最外层未满足8电子结构
C. 环氧乙烷与乙烷互为同系物
D. 工业上可以通过石油的裂解获得乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4N3(叠氮化铵)易发生爆炸反应: NH4N3![]() 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平衡体系Ca(OH)2(s)![]() Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
A. 加入少量MgCl2固体 B. 加入少量Na2CO3固体
C. 加入少量KCl固体 D. 加入少量稀H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A. Na2CO3![]() 2Na++CO32- B. Ba(OH)2
2Na++CO32- B. Ba(OH)2![]() Ba2++2OH—
Ba2++2OH—
C. H2SO4![]() 2H++SO42- D. KClO3
2H++SO42- D. KClO3![]() K++Cl-+3O2-
K++Cl-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼铁高炉中存在以下热化学方程式:
Ⅰ.C(s) +CO2(g)==2CO(g) ΔH1=+172.5 kJ·mol-1
Ⅱ.Fe2O3(s) +CO(g)![]() 2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
2FeO(s)+CO2(g) ΔH2=-3kJ·mol-1
Ⅲ.FeO(s)+CO(g) ![]() Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Fe(s) +CO2(g) ΔH3=-11 kJ·mol-1
Ⅳ. Fe2O3(s) +3CO(g) ![]() 2Fe (s)+3CO2(g) ΔH4
2Fe (s)+3CO2(g) ΔH4
(1)上述反应中,ΔH4=__________ kJ·mol-1。
(2)在实际生产中炼铁高炉中通人适量的空气,其主要作用是__________________。
(3)T℃时,在1L的密闭容器中加入20.0g Fe2O3和3.6gC,只发生反应:2 Fe2O3(s) +3C(s) ![]() 4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
4Fe(s) +3CO2(g),20 min 后达到平衡,固体质量变为19.2 g,用CO2 表示的反应速率为________。
(4)炼铁过程中发生反应:2 Fe2O3(s) +3CO(g)![]() 2Fe(s) +3CO2(g)。
2Fe(s) +3CO2(g)。
①下图中能表示该反应的平衡常数对数值(1g K) 与温度的关系的是______(填“Ⅰ”或“Ⅱ”),原因是__________________。

②1500℃时,在某体积可变的密闭容器中按物质的量比2∶3加入Fe2O3 和CO,则达平衡时Fe2O3的转化率是________。
③下列说法能够提高Fe2O3 的转化率的是________(填字母)。
A.升高反应体系的温度 B.加人适量的Na2O 固体
C.对体系加压 D.增大CO 在原料中的物质的量比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com