
【题目】一定温度下,在容积为V L的密闭容器里进行反应,M、N的物质的量随时间的变化曲线如图所示,且两者都为气体:
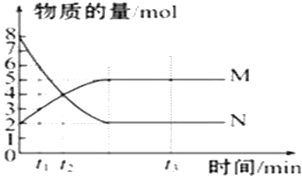
(1)此反应的化学方程式为__________________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:__________________。
(3)达平衡时N的转化率为:_______________ ;
(4)反应前与达平衡时容器内压强之比为_____________。
【答案】 2N![]() M
M ![]() molL-1min-1 75% 10:7
molL-1min-1 75% 10:7
【解析】(1)根据物质的量的变化判断反应物和生成物;根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=![]() 计算反应速率v(M);
计算反应速率v(M);
(3)根据N的转化率=![]() ×100%计算;
×100%计算;
(4)根据反应前与达平衡时容器内压强之比等于物质的量之比解答。
(1)由图像可知,随着反应进行,N的物质的量减少,M的物质的量增加,所以,N是反应物,M是生成物,随时间进行,N的物质的量为定值且不为零,反应为可逆反应,且△n(N):△n(M)=(8-2)mol:(5-2)mol=2:1,则反应的化学方程式为:2N![]() M,故答案为:2N
M,故答案为:2N![]() M;
M;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:v=![]() =
=![]() =
=![]() molL-1min-1,故答案为:
molL-1min-1,故答案为:![]() molL-1min-1;
molL-1min-1;
(3)根据图像,N的转化率=![]() ×100%=
×100%=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;
(4)反应前与达平衡时容器内压强之比等于物质的量之比=![]() =
=![]() ,故答案为:
,故答案为:![]() 。
。


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
2C(g) △H<0,在一定条件下达到平衡,若改变条件,将变化情况(“增大”、“减小”、“不变”)填入空格:
(1)升高温度,B的转化率___________,v(正)__________。
(2)使用催化剂,A的物质的量___________。
(3)增大压强,v(逆)___________,C的产率___________。
(4)增大A的浓度,则B的转化率____________,C的物质的量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________已知:K300℃>K350℃,则该反应是_______热反应图中表示NO2变化的曲线是__________上述反应在第5s时,NO的转化率为_________。
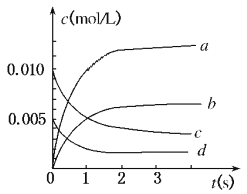
(2)能说明该反应已达到平衡状态的是__________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.1molN2所含有的原子数为NA
B.标准状况下,22.4L水中含有的水分子数为NA
C.标准状况下,22.4L氯化氢所含的原子数为NA
D.24gO2分子和24gO3分子所含的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的说法中,正确的是( )
A.许多胶体能进行电泳是因为这些胶体带电
B.布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

(1)表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
(2)NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁子香酚可用于制备杀虫剂和防腐剂,结构简式如右下图所示。下列说法中,不正确的是

A. 丁子香酚可通过加聚反应生成高聚物
B. 丁子香酚分子中的含氧官能团是羟基和醚键
C. 1 mol丁子香酚与足量氢气加成时,最多能消耗4 mol H2
D. 丁子香酚能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_____________。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是________________。(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_______。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构。则下列有关说法中错误的是( )
A. 1 mol NH5中含有5NA个N—H键(NA表示阿伏伽德罗常数的值)
B. NH5中既有共价键又有离子键
C. NH5的电子式为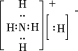
D. 它与水反应的化学方程式为NH5 +H2O===NH3·H2O+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com