
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

(1)表示NH3·H2O浓度变化的曲线是__________(填“A”或“B")。
(2)NH3·H2O的电离常数为_______(已知lg1.8 = 0.26)。
(3)当加入盐酸体积为50mL时,溶液中c(NH4+)- c(NH3·H2O) =_____mol/L (用数字表示)。
Ⅱ.若液氨中也存在类似水的电离( H2O+H2O![]() H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
H3O+ +OH-),碳酸钠溶于液氨后也能发生完全电离和类似水解的氨解。
(1)写出液氨的电离方程式_________.
(2)写出碳酸钠溶于液氨后第一级氨解的离子方程式__________
(3)写出碳酸钠的液氨溶液中各离子浓度的大小关系____________
【答案】 A 1.8×10-5或10-4.74 2×10-5-2×10-9 NH3+NH3![]() NH4++NH2- CO32-+2NH3
NH4++NH2- CO32-+2NH3![]() NH2-+NH4CO3- c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)
NH2-+NH4CO3- c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)
【解析】本题主要考查弱碱电离和盐类水解。
I.(1)NH3·H2O浓度越来越小,表示NH3·H2O浓度变化的曲线是A。
(2)NH3·H2O的电离常数为 =c(OH-)=10-(14-9.26)=10-4.74。
=c(OH-)=10-(14-9.26)=10-4.74。
(3)当加入盐酸体积为50mL时,形成等浓度的氯化铵和一水合氨的混合溶液,溶液中电荷守恒:c(H+)+c(NH4+)=c(OH-)+c(Cl-),元素守恒:2c(Cl-)=c(NH3·H2O)+c(NH4+),消去c(Cl-)得c(NH4+)-c(NH3·H2O)=2c(OH-)-2c(H+)=(2×10-5-2×10-9)mol/L。
Ⅱ.(1)液氨的电离方程式:NH3+NH3![]() NH4++NH2-。
NH4++NH2-。
(2)相似于碳酸钠的第一步水解,碳酸钠溶于液氨后第一级氨解的离子方程式:CO32-+2NH3![]() NH2-+NH4CO3-。
NH2-+NH4CO3-。
(3)类比碳酸钠的水解可以得出碳酸钠的液氨溶液中各离子浓度的大小关系:c(Na+)>c(CO32-)>c(NH2-)>c(NH4CO3-)>c(NH4+)。


科目:高中化学 来源: 题型:
【题目】下列化合物中哪些是配合物( )
①CuSO4·5H2O ②K2PtCl6 ③KCl·CuCl2④Cu(NH2CH2COO)2 ⑤KCl·MgCl2·6H2O⑥Cu(CH3COO)2
A. ①③④⑥ B. ②③⑤ C. ①② D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pAg=-lgc(Ag+),pCl=-lgc(Cl-),根据不同温度下氯化银饱和溶液的pAg和pCl可绘制图像如图所示,且已知氯化银的溶解度随温度的升高而增大,根据该图像,下列表述正确的是

A. A点表示的是T1温度下的不饱和溶液
B. 将A点的溶液降温,可能得到C点的饱和溶液
C. 向B点所表示的溶液中加入氯化钠溶液,溶液可能改变至D点
D. T3>T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明体检的血液化验单中,葡萄糖为5.9mmol/L.表示该体检指标的物理量是( )
A.溶解度(s)
B.物质的量浓度(c)
C.质量分数(w)
D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器里进行反应,M、N的物质的量随时间的变化曲线如图所示,且两者都为气体:
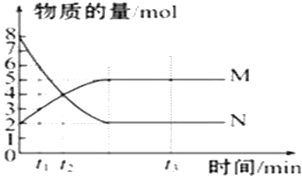
(1)此反应的化学方程式为__________________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:__________________。
(3)达平衡时N的转化率为:_______________ ;
(4)反应前与达平衡时容器内压强之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素,问:
(1)B元素在周期表中的位置为_________________;
(2)D的单质投入A2C中得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为_____________________。
(3)用电子式表示由A、C两元素组成的四核18电子的共价化合物的形成过程_____________。
(4)以往回收电路板中铜的方法是灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,该反应的化学方程式为___________________。
(5)乙醇(C2H5OH)燃料电池(Pt为电极),以KOH为电解质溶液,写出负极电极反应式__________,当转移电子1.2mol时,消耗氧气标况下体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是人工合成的激素药物,能改善体内激素的平衡状态,其结构如图。下列有关叙述正确的是( )
![]()
A. 该有机物的分子式为C18H22O2
B. 该物质含有的官能团有醇羟基、碳碳双键
C. 该物质对称性好,所以没有顺反异构
D. 该有机物分子中,最多可能有18个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4N3(叠氮化铵)易发生爆炸反应: NH4N3![]() 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com