
【题目】下列属于碱性氧化物的是
A.COB.Mn2O7C.CaOD.SO2
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.1molN2所含有的原子数为NA
B.标准状况下,22.4L水中含有的水分子数为NA
C.标准状况下,22.4L氯化氢所含的原子数为NA
D.24gO2分子和24gO3分子所含的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为_____________。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是________________。(填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________。(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_______。(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国《科学》杂志曾报道:在40 GPa的高压下,用激光加热到1800 K,人们成功制得了原子晶体CO2,下列对该物质的推断一定不正确的是( )
A. 该原子晶体中含有极性键 B. 该原子晶体易气化,可用作制冷材料
C. 该原子晶体有很高的熔点 D. 该原子晶体硬度大,可用作耐磨材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是( )
A. 金刚石和硫的熔化 B. 食盐和石蜡的熔化
C. 碘和干冰的升华 D. 二氧化硅和氧化钠的熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
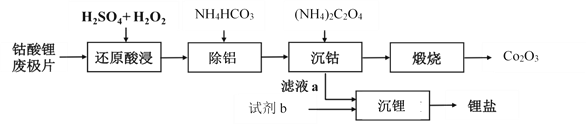
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ ![]() □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
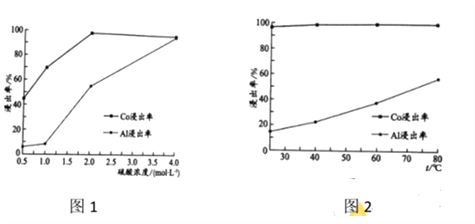
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0 oC | 36.1 g | 1.33 g |
100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构。则下列有关说法中错误的是( )
A. 1 mol NH5中含有5NA个N—H键(NA表示阿伏伽德罗常数的值)
B. NH5中既有共价键又有离子键
C. NH5的电子式为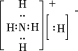
D. 它与水反应的化学方程式为NH5 +H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | |||||
3 | B | C | J | F | H | I |
(1)表中元素,化学性质最不活泼的元素是__________。
(2)最高价氧化物的水化物碱性最强的元素是__________。
(3)可用于制半导体材料的元素是_______。
(4)表中元素,只有负价没有正价的元素是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业利用氟磷灰石[Ca5(PO4)3F]生产磷铵[(NH4)3PO4]和白磷。其工艺流程如下图所示:

(1)氟磷灰石中磷元素的化合价为________,气体A 的电子式为________________;固体B 的化学式为____________________________。
(2)沸腾槽不能用陶瓷材质的原因是_______________________(用化学方程式表示)。
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500 ℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为____________________________。
(4)在装置I中通入过量氨气的目的是___________________________________________。
(5)磷铵与草木灰不能混合使用的原因是______________________________________。
(6) (NH4)3PO4溶液中含磷离子浓度的大小顺序是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com