
【题目】钴酸锂废极片中钴回收的某种工艺流程如下图所示,其中废极片的主要成分为钴酸锂(LiCoO2)和金属铝,最终可得到Co2O3及锂盐。
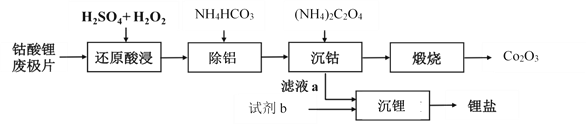
(1) “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,请将该反应的化学方程式补充完整:2LiCoO2+3H2SO4+□ ![]() □CoSO4+□ +□ + □ 。__________
□CoSO4+□ +□ + □ 。__________
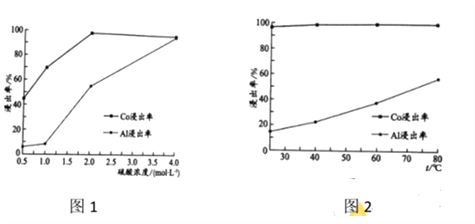
(2) “还原酸浸”过程中,Co、Al浸出率(进入溶液中的某元素质量占固体中该元素总质量的百分数)受硫酸浓度及温度(t)的影响分别如图1和图2所示。工艺流程中所选择的硫酸浓度为2 mol.L-1,温度为80 oC,推测其原因是________。
A. Co的浸出率较高 B. Co和Al浸出的速率较快
C. Al的浸出率较高 D. 双氧水较易分解
(3)加入(NH4)2C2O4后得CoC2O4沉淀。写出CoC2O4沉淀在空气中高温煅烧得到Co2O3的反应的化学方程式:________。
(4)若初始投入钴酸锂废极片的质量为1 kg,煅烧后获得Co2O3的质量为83 g,已知Co的浸出率为90%,则钴酸锂废极片中钴元素的质量分数约为________(小数点后保留两位)。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1 mol·L-1,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0 oC | 36.1 g | 1.33 g |
100 oC | 24.0 g | 0.72 g |
结合数据分析,沉锂过程所用的试剂b是________(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,________,洗涤干燥。
【答案】 2LiCoO2 + 3H2SO4 + H2O2![]() 2CoSO4 + Li2SO4 + O2↑+ 4H2O A B 4CoC2O4 + 3O2
2CoSO4 + Li2SO4 + O2↑+ 4H2O A B 4CoC2O4 + 3O2![]() 2Co2O3 + 8CO2 6.56 % Na2CO3 加热浓缩,趁热过滤
2Co2O3 + 8CO2 6.56 % Na2CO3 加热浓缩,趁热过滤
【解析】(1). “还原酸浸”过程中,大部分LiCoO2可转化为CoSO4,Co元素的化合价从+3价降低到+2价,则H2O2中O元素的化合价从-1价升高到0价,根据得失电子守恒和原子守恒,该反应的化学方程式为:2LiCoO2 + 3H2SO4 + H2O2= 2CoSO4 + Li2SO4 + O2↑+ 4H2O,故答案为:2LiCoO2 + 3H2SO4 + H2O2= 2CoSO4 + Li2SO4 + O2↑+ 4H2O;
(2). 由图1可知,当硫酸浓度为2 mol.L-1时,Co的浸出率较高,由图2可知,当温度为80℃,Co和Al浸出的速率较快,故答案选:AB;
(3). CoC2O4沉淀在空气中高温煅烧,CoC2O4被氧气氧化得到Co2O3,反应的化学方程式为:4CoC2O4 + 3O2= 2Co2O3 + 8CO2,故答案为:4CoC2O4 + 3O2= 2Co2O3 + 8CO2;
(4). 煅烧后获得Co2O3的质量为83 g,则Co原子的质量为:83×![]() =59g,Co的浸出率为90%,则1 kg钴酸锂废极片中钴元素的质量分数约为
=59g,Co的浸出率为90%,则1 kg钴酸锂废极片中钴元素的质量分数约为![]() ×100%=6.56 %,故答案为:6.56 %;
×100%=6.56 %,故答案为:6.56 %;
(5). 由表中数据可知,在相同温度下,Li2CO3的溶解度更小,且温度越高,Li2CO3的溶解度越小,则沉锂过程所用的试剂b是Na2CO3,相应的操作方法:向滤液a中加入略过量的Na2CO3,搅拌,加热浓缩,趁热过滤,洗涤干燥,故答案为:Na2CO3;加热浓缩,趁热过滤。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】小明体检的血液化验单中,葡萄糖为5.9mmol/L.表示该体检指标的物理量是( )
A.溶解度(s)
B.物质的量浓度(c)
C.质量分数(w)
D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是人工合成的激素药物,能改善体内激素的平衡状态,其结构如图。下列有关叙述正确的是( )
![]()
A. 该有机物的分子式为C18H22O2
B. 该物质含有的官能团有醇羟基、碳碳双键
C. 该物质对称性好,所以没有顺反异构
D. 该有机物分子中,最多可能有18个碳原子共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示资源开发、回收、利用原理的反应方程式不正确的是( )
A. 海水提溴时用SO2吸收Br2蒸气:SO2+Br2+2H2O=2HBr+H2SO4
B. 将煤气化为可燃性气体:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
C. 用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3
D. 可以用铝和氧化铁制备铁单质:2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲、乙两电解池,其中碳棒上有黄绿色气体产生。
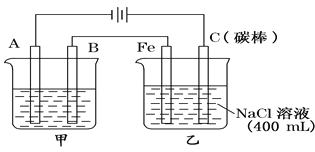
(1)甲池若为用电解原理精炼铜的装置,则:A是________极,电极反应为__________________,当一极有1mol纯铜析出时,另一极溶解的铜___________1mol(填“大于”、“小于”、“等于”)。
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe电极附近呈________色,电极反应式为_________。
(3)若甲池中电解质溶液为CuSO4溶液,电解过程中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为_______L,若此时乙池剩余液体为400 mL,则电解后溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4N3(叠氮化铵)易发生爆炸反应: NH4N3![]() 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲烷燃烧生成二氧化碳和液态水放出的热量为55.625 kJ·g-1。下列热化学方程式中不正确的是( )
A.CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH =-890 kJ/mol
B.![]() CH4(g)+O2(g)
CH4(g)+O2(g)![]() CO2(g)+H2O(l) ΔH=-445 kJ/mol
CO2(g)+H2O(l) ΔH=-445 kJ/mol
C.![]() CO2(g)+H2O(l)
CO2(g)+H2O(l)![]() CH4(g)+O2(g) ΔH=+445 kJ/mol
CH4(g)+O2(g) ΔH=+445 kJ/mol
D.CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH=-55.625 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是( )
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=![]()
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com