
【题目】食盐中所加的碘以碘酸钾(KIO3)形式存在。根据反应:IO![]() +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为1∶5
B.实验时可观察到试纸变蓝
C.实验可证明该条件下I-的还原性强于Cl-
D.食醋中含有的乙酸是强酸,它能提供反应所需的H+
【答案】D
【解析】
配平后的反应为:IO![]() +5I-+6H+═3I2+3H2O,结合实验的原理和现象分析解答。
+5I-+6H+═3I2+3H2O,结合实验的原理和现象分析解答。
A.配平后的反应为:IO![]() +5I-+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价由+5价变化为0价,IO
+5I-+6H+═3I2+3H2O,反应中碘酸根离子中碘元素化合价由+5价变化为0价,IO![]() 为氧化剂,碘离子中I的化合价由-1价变化为0价,I-为还原剂,则反应中氧化剂和还原剂的物质的量之比为1∶5,故A正确;
为氧化剂,碘离子中I的化合价由-1价变化为0价,I-为还原剂,则反应中氧化剂和还原剂的物质的量之比为1∶5,故A正确;
B.用淀粉KI试纸和食醋进行实验,发生反应IO![]() +5I-+6H+═3I2+3H2O,生成的碘单质遇到淀粉变蓝色,故B正确;
+5I-+6H+═3I2+3H2O,生成的碘单质遇到淀粉变蓝色,故B正确;
C.食盐中含有Cl-,在含有IO![]() 和Cl-的体系中加入KI淀粉试纸和食醋进行实验,碘离子被氧化,而Cl-不被氧化,所以实验可证明该条件下I-还原性强于Cl-,故C正确;
和Cl-的体系中加入KI淀粉试纸和食醋进行实验,碘离子被氧化,而Cl-不被氧化,所以实验可证明该条件下I-还原性强于Cl-,故C正确;
D.乙酸为弱酸,不是强酸,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】元素a--f在周期表中的位置如表所示,下列有关说法正确的是
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
二 | c | d | |||||
三 | a | b | e | f |
A. c、d、e的氢化物中,e的氢化物沸点最高
B. a、b、d三种元素的离子半径:a >b >d
C. 六种元素中,a元素的金属性最强
D. e、f的氧化物对应的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO![]() [Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2
[Cu(NH3)3CO]+,2CH3COOH+2CH2=CH2+O2![]() 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为____。
(2)NH3分子空间构型为____。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_____,1molCH3COOCH=CH2中含![]() 键数目为____。
键数目为____。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为_______。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构可用示意图表示为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。下列说法正确的是( )
X | Y | |
Z | W |
A.原子半径:X>Y>Z>W
B.若它们都能形成气态氢化物,则Z的氢化物稳定性最强
C.若常温下它们的单质中只有Z为固态,则W单质的水溶液具有漂白性
D.若X与W形成的化合物的电子式是![]() ,则Y属于第ⅣA族
,则Y属于第ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,丙的浓溶液是具有强氧化性的酸溶液,上述物质的转化关系如图所示。下列说法正确的是( )
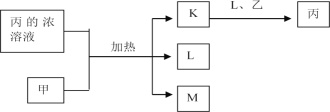
A. 电负性:W>X>YB. 原子的第一电离能:Z>Y>X
C. 由W、X、Y、Z构成化合物中只含共价键D. K、L、M中沸点最高的是M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质进行分类:
①![]() H与
H与![]() H;②O2与O3;③乙醇(C2H5OH)与甲醚(CH3—O—CH3);④正戊烷(CH3CH2CH2CH2CH3)与异丁烷(
H;②O2与O3;③乙醇(C2H5OH)与甲醚(CH3—O—CH3);④正戊烷(CH3CH2CH2CH2CH3)与异丁烷(![]() )
)
(1)互为同位素的是_____(填序号、下同);
(2)互为同系物的是_____;
(3)互为同分异构体的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为![]()
B. 常温常压下,8 g O2含有的电子数是4NA
C. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D. 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用降温结晶的方法可将叔丁醇从二者的混合物中结晶出来
D. 两种醇发生消去反应后得到同一种烯烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com