
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为![]()
B. 常温常压下,8 g O2含有的电子数是4NA
C. 标准状况下,2.24 L CCl4中含有的分子数为0.1NA
D. 25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2![]()
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和漂白性物质 |
B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定含有CO |
C | 向某溶液中加入AgNO3溶液,产生白色沉淀 | 该溶液中一定含有Cl- |
D | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有吸水性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水提取镁和溴的流程如图,请回答相关问题。
(1)从海水中提取镁的流程如图所示(框图中是主要产物):
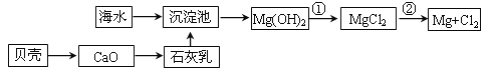
i.反应①的离子方程是_____;
ii.反应②的化学方程式是_____。
(2)从海水中提取溴的流程如图所示(框图中是主要产物):
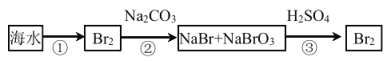
i.过程②中,向混合液中吹入热空气,将溴吹出,用纯碱吸收,吹入热空气的目的是______。
ii.过程③中反应的化学方程式是______。
iii.若最终得到的溴单质中仍然混有少量的Cl2,则除去该杂质的方法是______。(结合离子方程式回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中所加的碘以碘酸钾(KIO3)形式存在。根据反应:IO![]() +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为1∶5
B.实验时可观察到试纸变蓝
C.实验可证明该条件下I-的还原性强于Cl-
D.食醋中含有的乙酸是强酸,它能提供反应所需的H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为元素周期表中前四周期元素,原子序数依次增大,A元素原子核外有3个未成对电子,B元素原子核外电子占用3个能级,其中最高能级上的电子数是其所在能层数的2倍,D元素与B元素同族,C元素与A元素同族,E元素原子的价电子数是其余电子数的一半。
(1)A、C、D的第一电离能由大到小的顺序为___________________(用元素符号表示),E2+的基态电子排布式为__________________________________。
(2)B和D的氢化物中,B的氢化物沸点较高的原因是____________________________。
(3)C形成的最高价氧化物的结构如图所示,该结构中C-B键的键长有两类,键长较短的键为__________(填“a”或“b”)。
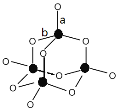
(4)E可与CO形成羰基配合物E2(CO)8,是有机合成的重要催化剂,不溶于水,溶于乙醇、乙醚、苯,熔点50~51℃,45℃(1.33kPa)时升华。
① E2(CO)8为_________晶体。(填晶体类型)
② E2(CO)8晶体中存在的作用力有______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
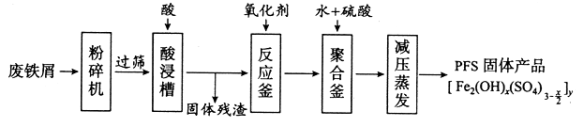
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对两种有机物甲和乙的描述不正确的是( )
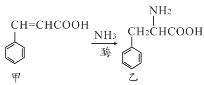
A.甲中所有碳原子不可能在同一平面上
B.甲、乙均能发生加成反应、氧化反应、取代反应
C.甲、乙均能在一定条件下通过聚合反应生成高聚物
D.甲、乙苯环上的一硝基取代物种数相同(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com