
| A. | 原电池外电路中电子由负极流向正极 | |
| B. | 原电池中发生还原反应的电极是正极 | |
| C. | 电解池中发生还原反应的电极是阳极 | |
| D. | 电解池中质量增加的电极是阴极 |
分析 A、原电池中负极失电子,正极上溶液中的离子得电子;
B、原电池中,正极上溶液中的离子得电子;
C、电解池中,阳极上电极或溶液中的阴离子失电子;
D、电解池中,阴极上阳离子得电子.
解答 解:A、原电池中负极失电子,正极上溶液中的离子得电子,所以外电路中电子由负极流向正极,故A正确;
B、原电池中,正极上溶液中的离子得电子,化合价降低,发生还原反应,故B正确;
C、电解池中,阳极上电极或溶液中的阴离子失电子,失电子发生氧化反应,故C错误;
D、电解池中,阴极上阳离子得电子,若电极的质量增加,说明该极有金属单质生成,则该极为阴极,故D正确.
故选C.
点评 本题考查了原电池原理和电解池原理,题目难度不大,会判断电子在外电路的流向及溶液中阴阳离子的移动方向,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题
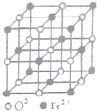 (1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、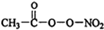 (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:多选题
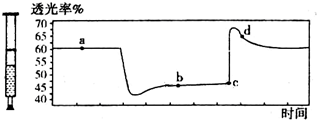 已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | c点的操作是拉伸注射器 | |
| B. | b点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb | |
| D. | d点:v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一段时间后铜片增重,盐桥中K+移向CuSO4溶液 | |
| B. | 正极反应为:Zn-2e-═Zn2+ | |
| C. | 电子从铜片经导线流向锌片 | |
| D. | 电池工作时Zn2+和Cu2+ 的浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 适当增大压强 | ||
| C. | 加入催化剂 | D. | 从容器中分离出氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com