

| A. | 一段时间后铜片增重,盐桥中K+移向CuSO4溶液 | |
| B. | 正极反应为:Zn-2e-═Zn2+ | |
| C. | 电子从铜片经导线流向锌片 | |
| D. | 电池工作时Zn2+和Cu2+ 的浓度保持不变 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,以此解答该题.
解答 解:A、正极反应为Cu2++2e-=Cu,所以铜棒上有Cu析出,质量增大,盐桥中阳离子向正极移动,即盐桥中K+移向CuSO4溶液,故A正确;
B、铜为正极,正极上铜离子得电子,即发生Cu2++2e-=Cu,故B错误;
C、在外电路中,电子从电池负极经外电路流向正极,即电子从锌片经导线流向铜片,故C错误;
D、电池工作时,负极锌失电子生成锌离子,则Zn2+浓度增大,正极上铜离子得电子生成Cu,则Cu2+ 的浓度减小,故D错误;
故选:A.
点评 本题考查原电池的工作原理,注意把握工作原理以及电极方程式的书写,题目难度不大,侧重于考查学生的分析能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:K+、Cu2+、NO3-、AlO2- | |
| B. | 空气:CH4、CO2、SO2、NO | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br - | |
| D. | 各离子物质的量浓度相等的溶液:K+、Mg2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ka(H2CO3)<Ka(CH3COOH)说明相同物质的量浓度时,碳酸的酸性比醋酸的强 | |
| B. | 一般情况下,当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大 | |
| C. | 在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 | |
| D. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池外电路中电子由负极流向正极 | |
| B. | 原电池中发生还原反应的电极是正极 | |
| C. | 电解池中发生还原反应的电极是阳极 | |
| D. | 电解池中质量增加的电极是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,正、逆反应速率均加快 | |
| B. | 增大压强,化学平衡正向移动 | |
| C. | 充入O2,可提高SO2的转化率 | |
| D. | 当气体总质量不变时,反应达平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
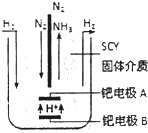 氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用.
氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用. [N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).
[N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴入盐酸,有无色无味的气体产生,说明某溶液一定含有含CO32- | |
| B. | 向某溶液中加入NaOH溶液,并加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明某溶液中一定含有NH4+ | |
| C. | 向某溶液中滴加氯化钡溶液,得到白色沉淀,说明某溶液中一定含有SO42- | |
| D. | 向某溶液中加入过量的NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明某溶液中一定含有Fe2+,一定不含有Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
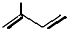 :2-甲基-1,3-丁二烯;该物质与溴单质以物质的量之比1:1发生加成反应可能的产物有3 种;
:2-甲基-1,3-丁二烯;该物质与溴单质以物质的量之比1:1发生加成反应可能的产物有3 种;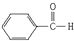 :苯甲醛;
:苯甲醛;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com