
【题目】某化学兴趣小组的同学用如下图所示装置研究有关电化学的问题。当闭合K时,观察到电流表的指针发生了偏移。
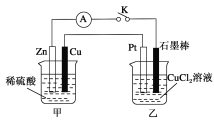
请回答下列问题:
(1)乙装置的名称是________;Zn为________极。
(2)写出电极反应:Cu极:______________________;石墨棒极:______________________。
(3)当甲中产生0.1mol气体时,乙中产生的气体在标准状况下的体积应为________________。
(4)若乙中溶液不变,将其电极都换成铜电极,闭合K一段时间后,乙中溶液的颜色________(填“变深”、“变浅”或“无变化”)。
(5)若乙中电极不变,将其溶液换成NaCl溶液,闭合K一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。
(6)若乙中电极不变,将其溶液换成饱和Na2SO4溶液,闭合K一段时间,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O析出,假设温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
【答案】电解池 负 2H++2e-=H2↑ Cu2++2e-=Cu 2.24L 无变化 增大 增大 ![]() ×100%
×100%
【解析】
在甲池中,有自发的氧化还原反应Zn+2H+=Zn2++H2↑,因此甲池为原电池,而乙为电解池,在甲池中,Zn失去电子,被氧化,作负极,电极方程式为Zn-2e-=Zn2+;Cu作正极,溶液中的H+得到电子,生成H2,电极方程式为2H++2e-=H2↑。乙池中,石墨与Zn相连,则石墨作阴极,溶液中的Cu2+得电子生成Cu,电极方程式为Cu2++2e-=Cu;Pt,惰性电极,与Cu相连,作阳极,溶液中的Cl-失电子,电极方程式为2Cl--2e-=Cl2↑。
(1) 在甲池中,有自发的氧化还原反应Zn+2H+=Zn2++H2↑,因此甲池为原电池,而乙为电解池,在甲池中,Zn失去电子,被氧化,作负极;
(2)根据分析,在甲池中,Zn失去电子,被氧化,作负极,电极方程式为Zn-2e-=Zn2+;Cu作正极,溶液中的H+得到电子,生成H2,电极方程式为2H++2e-=H2↑;
(3)当甲中产生了0.1mol气体,即0.1molH2,根据电极方程式,生成0.1molH2转移了0.2mol电子,则乙中,也转移0.2mol电子,生成0.1mol氯气,在标准状况下的体积为2.24L;
(4)若乙中溶液不变,将其电极都换成铜电极,Cu为活性电极,则阳极反应变为Cu-2e-=Cu2+,而阴极仍为Cu2++2e-=Cu,阳极产生的Cu2+和阴极消耗的Cu2+相等,则溶液中的Cu2+浓度不变,溶液的颜色不变;
(5)甲中消耗了H+,pH增大;电解NaCl溶液,则阴极为水得到电子,电极方程式为2H2O+2e-=H2↑+2OH-,乙中生成了OH-,pH增大;
(6)电解饱和Na2SO4溶液,Na+和SO42-均不放电,实质为电解水,阴极上有amol气体生成式,同时有w g Na2SO4·10H2O析出,假设温度不变,由于电解的是饱和Na2SO4溶液,则剩余的溶液是饱和溶液,电解消耗的水和析出的晶体,也能构成Na2SO4的饱和溶液,则可以根据析出的晶体和电解消耗的水,求解饱和Na2O4溶液中溶质的质量分数,阴极生成的为H2,根据总反应方程式2H2O![]() 2H2↑+O2↑;阴极生成amolH2,则电解了amolH2O,则析出的物质的总质量为(w+18a)g,溶质Na2SO4的质量为
2H2↑+O2↑;阴极生成amolH2,则电解了amolH2O,则析出的物质的总质量为(w+18a)g,溶质Na2SO4的质量为![]() ,则溶质的质量分数应为
,则溶质的质量分数应为![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知(CH3)2C=CH2,可表示为![]() ,脱落酸(如图)可用作植物生长抑制剂,下列对该物质的叙述正确的是( )
,脱落酸(如图)可用作植物生长抑制剂,下列对该物质的叙述正确的是( )
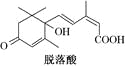
A.其分子式为C15H22O4
B.其属于芳香族化合物
C.1 mol该物质最多可与3 mol H2发生反应
D.该物质在一定条件下可发生自身取代反应生成含七元环的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
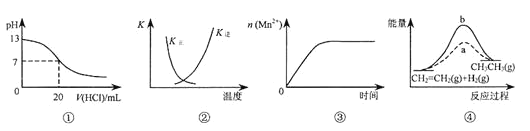
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K=2.25,该温度下,在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如表所示,下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2(mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2)是0.08mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.14g乙烯、丙烯、丁烯的混合气体中所含原子数为3NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2L氯仿所含分子数为0.5NA
D.32g甲醇中含有C—H键数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,一固定体积的密闭容器中发生反应:A(s)+3B(g)![]() 2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
2C(g)+D(g),下列描述中不能说明该反应到达平衡状态的是
①混合气体的压强不再变化
②单位时间内生成2a mol C,同时生成3a mol B
③气体密度不再变化
④A的质量不再变化
⑤气体的平均相对分子质量不再变化
⑥2v逆(C)=3v正(B)
A.①③B.②⑤C.①⑥D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①甲烷、②乙烷、③丙烷、④丁烷4种烷烃,试回答下列各题(填序号):
a.上述气态烃中,其一氯取代物的同分异构体只有两种的是___。
b.等物质的量上述气态烃充分燃烧,消耗O2的量最多的是___。
c.等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是__。
(2)有4种无色液态物质: a.1-庚烯[CH3(CH2)4CH=CH2]、b.戊烷[ CH3(CH2)3CH3]、c.苯(![]() )、d.甲苯(
)、d.甲苯(![]() ),
),
请回答下列问题:
①能与溴水和酸性KMnO4溶液反应的是__(写编号),
②不能与溴水反应但能与酸性KMnO4溶液反应的是___(写编号)。
③不能与溴水和酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是___(写编号),反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=2 mol·L-1·min-1B.v(A)=0.2 mol·L-1·s-1
C.v(C)=0.1 mol·L-1·s-1D.v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g),已知下列化学键的键能:
2NH3(g),已知下列化学键的键能:
化学键 | 键能kJ/mol |
H-H | 436 |
N-H | 391 |
N | 946 |
下列说法正确的是
A. 该反应为吸热反应B. 该反应中反应物的总能量高于生成物的总能量
C. 反应热ΔH=92 kJ·mol-1D. 生成1 mol NH3放出92 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com