
【题目】(1)除去NaHCO3溶液中混有的Na2CO3,相应的化学方程式_____________。
(2)除去Na2CO3固体中混有的NaHCO3,相应的化学方程式_____________。
(3)除去CO2气体中混有的HCl,相应的离子方程式___________________。
(4)除去Fe2O3中混有的Al2O3,相应的离子方程式_____________________。
(5)除去FeCl3溶液中混有的FeCl2,相应的离子方程式__________________。
【答案】 Na2CO3 + H2O + CO2= 2NaHCO3 2NaHCO3![]() Na2CO3 + H2O + CO2↑ HCO3-+ H+ = H2O + CO2↑ Al2O3+2OH-===2AlO2-+H2O 2Fe2++Cl2=2Fe3+ + 2Cl-
Na2CO3 + H2O + CO2↑ HCO3-+ H+ = H2O + CO2↑ Al2O3+2OH-===2AlO2-+H2O 2Fe2++Cl2=2Fe3+ + 2Cl-
【解析】(1)除去NaHCO3溶液中含有的Na2CO3溶质可在溶液中通入二氧化碳气体,Na2CO3溶液可与中氧化碳反应生成NaHCO3,化学方程式:Na2CO3+H2O+CO2=2NaHCO3,故答案为:Na2CO3+H2O+CO2=2NaHCO3;
(2)NaHCO3不稳定,加热易分解,可用加热的方法除杂,反应的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑,故答案为:2NaHCO3
Na2CO3+H2O+CO2↑,故答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(3)二氧化与碳酸氢钠不发生反应,而碳酸氢钠能够与氯化氢发生反应,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
(4)Al2O3为两性氧化物,可与强碱反应,则用强碱性溶液可除去Al2O3杂质,反应的离子方程式为Al2O3+2OH-===2AlO2-+H2O,故答案为:Al2O3+2OH-===2AlO2-+H2O;
(5)除去FeCl3中混有的FeCl2,可加入氧化剂,但不能引入新的杂质所以选用氯气;反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】下列有关铁的叙述中,不正确的是( )
A.铁具有良好的延展性、导电性、导热性
B.铁的化学性质非常不活泼
C.在化学反应中,铁能生成+2价或+3价的化合物
D.铁是钢的主要成份,钢铁是主要的金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | Cl-、NO3-、SO42-、CO32-、AlO2- |
为探究其成分,进行了探究实验。取一定量的溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示:

(1)该溶液中一定不存在的阳离子是_____________
(2)该溶液中一定不存在的阴离子是_____________
(3)该溶液中含有的阳离子其对应的物质的量浓度之比为____________________________
(4)写出沉淀减少过程中发生反应的离子方程式____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向久置于空气中的FeSO4溶液中滴加NaOH溶液 | 立刻产生大量白色沉淀 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数 ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( ) 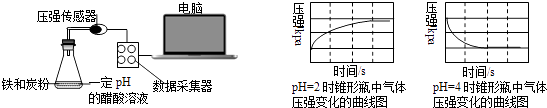
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中均为化合物的一组是
A. 金刚石、干冰、SO2 B. KCl、盐酸、NaOH
C. CuSO4·5H2O、冰、乙醇 D. 臭氧、CaCO3、铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:(要写计算过程)
(1)NO的体积为 _L,NO2的体积为 _L;(保留2位有效数字)
(2)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。(列出计算式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com