
 碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.
碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.分析 (1)Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+;
(2)铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,1个H2O含2个O-H键,则[Cu(H2O)4]2+含有12个σ键;
(3)利用价层电子对互斥模型判断;原子个数相等、价电子数相等的微粒互为等电子体;
(4)根据价层电子对互斥理论判断NO3-的空间构型;
(5)根据均摊法计算.
解答 解:(1)Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+,Cu2+基态核外电子排布式为1s22s22p63s23p63d9,N原子含有孤对电子,与Cu2+形成配位键,
故答案为:1s22s22p63s23p63d9;
(2)Cu2+含有空轨道,H2O含有孤对电子,可形成配位键,铜离子配体数为4,配离子[Cu(H2O)4]2+中1个Cu2+与4个H2O形成配位键,1个H2O含2个O-H键,所以1mol水合铜离子中含有σ键数目为12NA,
故答案为:12NA;
(3)CO32-中孤对电子$\frac{4+2-3×2}{2}$=0,价层电子对数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;原子个数相等、价电子数相等的微粒互为等电子体,二氧化碳分子中原子个数是3、价电子数是16,与二氧化碳互为等电子体的阴离子是SCN-,
故答案为:sp2;SCN-;
(4)NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,
故答案为:平面三角形;
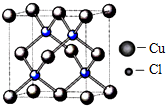
(5)晶胞中,处于面上的是Cu有6×$\frac{1}{2}$=3,处一顶点的有8×$\frac{1}{8}$=1个,共有4个,处于体内的Cl有4个,则该氯化物的化学式是CuCl,
故答案为:CuCl.
点评 本题综合考查物质的结构与性质知识,侧重于电子排布式、等电子体、杂化类型与配位键等知识,题目难度中等,注意把握杂化类型的判断方法,试题知识点较多、综合性较强,充分考查了学生的灵活应用能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 106g | B. | 90.7g | C. | 77.8g | D. | 66.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
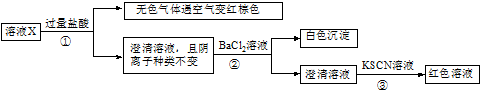
| A. | 无色气体可能是NO和CO2的混合物 | |
| B. | 原溶液可能存在Fe3+ | |
| C. | 溶液X中所含离子种类共有4种 | |
| D. | 另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
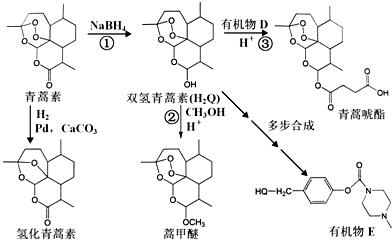
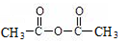 +H-OH→2
+H-OH→2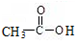
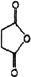 .
.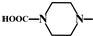 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.写出其中一种的结构简式 或
或 或
或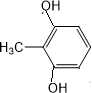 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物的水化物的碱性:A<C | |
| B. | B、D形成的化合物的溶于水形成B2D3溶液 | |
| C. | A、E形成的化合物只含离子键和极性键 | |
| D. | E的单质可以从D的氢化物中置换出D单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径大小顺序为:Z>X>Y>W | |
| B. | W、X、Y三种元素都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | X、Y、Z三种元素与W 元素形成的最简单化合物的沸点依次升高 | |
| D. | X、Y、Z三种元素形成的化合物的水溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com