
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O42NO2△H>0) (a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
【答案】D
【解析】解:(a)在沸水中,气体体积都受热膨胀,甲中存在平衡N2O42NO2 △H>0,升高温度,平衡正向移动,使体积进一步增大,所以体积:甲>乙;(b)都加2kg的砝码,压强增大,气体都缩小,甲中存在平衡N2O42NO2 △H>0,增大压强,平衡逆向移动,体积减小得更多,所以体积:甲<乙;
故选D.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
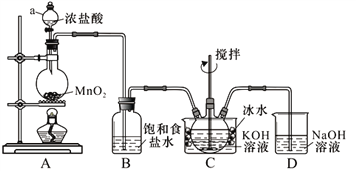
<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)装置C中三颈瓶置于冰水浴中的目的是_____________。
(2)装置B吸收的气体是___________,装置D的作用是__________________________。
(3)C中得到足量KClO后,将三颈烧瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为______________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③____________________________________。
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.用金属钠可区分乙醇和乙醚
B.用高锰酸钾酸性溶液可区分己烷和3﹣己烯
C.用水可区分苯和溴苯
D.用新制的银氨溶液可区分甲酸甲酯和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中重金属铅的污染问题备受关注。查资料知Pb4+具有很强的氧化性,水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2( 在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量分数a随溶液pH变化的关系如下图所示:

下列有关说法正确的是
A. Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)=1/2
B. 向Pb(NO3)2波中滴加氯化铵溶液,溶液中c(Pb2+)/c(NO3-)变小,可能是Cl-与Pb2+发生反应
C. 向Pb(NO3)2溶液中滴加NaOH溶液,pH 越大,生成沉淀越多
D. pH=12时,混合体系中发生的主要反应的离子方程式为Pb(OH)3-+OH-=Pb(OH)42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则25℃时水的电离平衡曲线应为(填“A”或“B”),请说明理由
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 .
(4)曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8.请分析其原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH的电离常数K=1.6×10﹣5 . 该温度下,向20mL 0.01molL﹣1 CH3COOH溶液中逐滴加入0.01molL﹣1 KOH溶液,回答下列有关问题:
(1)醋酸溶液中c(H+)为 , pH约为 .
(2)用滴定管取CH3COOH溶液20.00mL放在锥形瓶中,滴加几滴酚酞,待测.滴定管在使用前除洗涤外,还应 .
(3)判断到达滴定终点的实验现象是;
(4)下列操作中,可能使所测CH3COOH溶液的浓度偏低的是
A.碱式滴定管未用标准碱液润洗就直接注入标准液
B.读取碱液体积时,开始仰视读数,滴定结束时俯视读数
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定前盛放CH3COOH溶液的锥形瓶用蒸馏水洗净后没有干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请同学们根据官能团的不同对下列有机物进行分类.把正确答案填写在题中的横线上①CH3CH2OH② ![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤ ![]() ⑥
⑥ ![]() ⑦
⑦ ![]() ⑧
⑧ ![]() ⑨
⑨ ![]() ⑩
⑩ ![]()
(1)芳香烃:;
(2)卤代烃:;
(3)醇:;
(4)酚:;
(5)醛:;
(6)酮:;
(7)羧酸:;
(8)酯: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.24L甲烷气体中碳氢键的数目为0.4NA
B. lmolSO2与足量的O2反应,转移的电子数为2NA
C. 1 mol·L-1CH3COOH 与1 mol·L-1CH3COONa 溶液等体积混合,溶液中CH3COOH 和CH3COO-的总数为2NA
D. 7.8g乙炔与苯的混合物完全燃烧所消耗的O2分子数为0.75NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com