
【题目】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
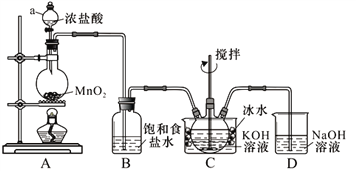
<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)装置C中三颈瓶置于冰水浴中的目的是_____________。
(2)装置B吸收的气体是___________,装置D的作用是__________________________。
(3)C中得到足量KClO后,将三颈烧瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为______________。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③____________________________________。
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
【答案】 防止Cl2与KOH反应生成KClO3 HCl 吸收Cl2,防止污染空气 3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O 将滤液置于冰水浴中,向滤液中加入饱和KOH溶液
【解析】根据实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收。
(1)根据装置图可知Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3,故答案为:防止Cl2与KOH反应生成KClO3;
(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收,所以装置B吸收的气体是HCl,装置D的作用是吸收Cl2,防止污染空气,故答案为:HCl;吸收Cl2,防止污染空气;
(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O,故答案为:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥,故答案为:将滤液置于冰水浴中,向滤液中加入饱和KOH溶液。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是




图1 图2 图3 图4
A. 图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B. 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到的滴定曲线
D. 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分类或归类正确的是
①硫酸、氨水、干冰、碘化银均为纯净物 ②CaCl2、NaOH、HCl、IBr均为化合物
③明矾、水银、烧碱、硫酸均为电解质 ④二氧化硫、氨气、乙醇都是非电解质
⑤碘酒、淀粉、云雾、纳米材料均为胶体
A.①③④B.②③C.②④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量Mg与100mL4mol/L的盐酸反应,固体全部溶解后再加入2mol/L的NaOH溶液,生成沉淀最多时至少需加入氢氧化钠溶液体积为
A. 200mL B. 250mL C. 300mL D. 400mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O―→[CH3CH(OH)COO]2Fe·3H2O+CO2↑。已知FeCO3易被氧化:4FeCO3+6H2O+O2===4Fe(OH)3+4CO2。某兴趣小组用FeCl2(用铁粉和稀盐酸制得)和NH4HCO3制备FeCO3的装置示意图如下:
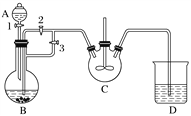
回答下列问题:
(1)NH4HCO3盛放在装置__________(填字母)中,该装置中涉及的主要反应的离子方程式________________________________________________________________________。
(2)将生成的FeCl2溶液和NH4HCO3溶液混合时的操作是____________________。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75 ℃下搅拌反应。铁粉的作用是________________________________________________________________________,反应结束后,无需过滤,除去过量铁粉的方法是_________________________________.
(4)经查阅文献后,该兴趣小组用铈(Ce)量法测定产品中Fe2+的含量。取2.880 g产品配成100 mL溶液,每次取20.00 mL,进行必要处理,用0.100 0 mol·L-1 Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2 19.70 mL。滴定反应如下:Ce4++Fe2+===Ce3++Fe3+,则产品中乳酸亚铁的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色。反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨。
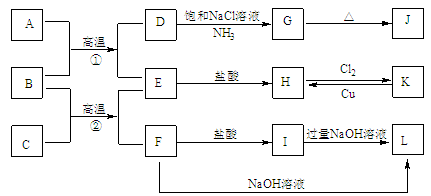
请回答下列问题:
(1)B的化学式为 ,J的化学式为 。
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 。
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 。
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 。
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O42NO2△H>0) (a)将两容器置于沸水中加热
(b)在活塞上都加2kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙,(b)甲>乙
B.(a)甲>乙,(b)甲=乙
C.(a)甲<乙,(b)甲>乙
D.(a)甲>乙,(b)甲<乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com