
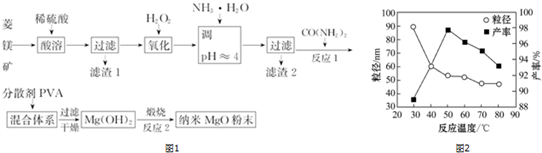
分析 菱铁矿(主要成分为MgCO3,含少量FeCO3、SiO2)加入稀硫酸酸溶,二氧化硅不反应,过滤分离,滤渣1为SiO2,过滤得到滤液中含有硫酸镁、硫酸亚铁、未反应的硫酸,滤液中加入过氧化氢,将Fe2+氧化为Fe3+,则加入一水合氨调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤除去,滤液中含有硫酸镁、硫酸铵等,加入CO(NH2)2始产生沉淀,加入PVA进行分散,过滤干燥得到氢氧化镁沉淀,高温煅烧制备纳米氧化镁,
(1)二氧化硅不与硫酸反应;
(2)酸性条件下,H2O2将Fe2+氧化为Fe3+;
(3)滤渣2为氢氧化铁,氢氧化铁煅烧分解生成的氧化铁,灼烧固体需要在坩埚中进行;
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,根据原子守恒可知弱碱为一水合氨;
(5)Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.96×10-11计算;
(6)利用丁达尔现象可鉴别胶体,根据图,选择产率高、粒径小的温度.
解答 解:(1)二氧化硅不与硫酸反应,滤渣1为SiO2,
故答案为:SiO2;
(2)酸性条件下,H2O2将Fe2+氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)滤渣2为氢氧化铁制,煅烧氢氧化铁分解生成的氧化铁,化学式为Fe2O3,灼烧固体需要在坩埚中灼烧,
故答案为:Fe2O3;坩埚;
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,依据原子守恒可知弱碱为一水合氨,反应的化学方程式为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O,所以该反应中反应物CO(NH2)2与H2O物质的量之比为1:3,则质量之比为1×60:3×18=10:9,
故答案为:CO(NH2)2+3H2O=CO2↑+2NH3•H2O;10:9;
(5)当 Mg2+沉淀完全时,溶液中c(Mg2+)=1.0×10-5 mol•L-1,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.96×10-11,可知c(OH-)=1.4×10-3 mol•L-1,
故答案为:1.4×10-3 mol•L-1;
(6)利用丁达尔现象可鉴别胶体,所以能说明是纳米MgO存在的简单方法是用一束光照射,在侧面会看到一条光亮的通路,图1为反应温度对纳米MgO产率和粒径的影响,50℃时氧化镁产率最大,粒径较小,温度再高,产率减小,粒径变化不大,故反应的最佳温度为50℃,
故答案为:用一束光照射,在侧面会看到一条光亮的通路;50℃.
点评 本题考查物质准备工艺流程,涉及条件的控制与选择、对操作的分析评价、胶体的性质等,注意掌握元素化合物性质,是对学生综合能力的考查,是高考常见题型.


科目:高中化学 来源: 题型:解答题
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、 柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80%生产日期标于包装袋封口上 |
| 实例 | 性质 |
| 紫外线消毒 | 变性 |
| 蛋白质遇浓硝酸变黄 | |
| 误食了重金属离子,可以立即喝大量的牛奶来缓解 毒性 | |
| 鸡蛋清溶液中加入少量饱和的硫酸铵溶液出现沉淀 | |
| 常用酒精清洗伤口 | |
| 蒸煮鸡蛋食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑦ | B. | ①②⑦ | C. | ①⑥⑦ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
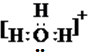 和
和 ;
;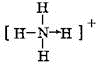 和O=C=O.
和O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤ | C. | ②③④ | D. | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com