
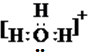 和
和 ;
; 和O=C=O.
和O=C=O. 分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,单键中含有一个σ键,双键、三键中含有σ键和π键,结合分子的空间构型和电子式解答.
解答 解:①N2H4 中含有N-H键和N-N键,N原子上含有一个孤电子对;
②P4中含有P-P键,P原子上含有孤电子对;
③H2O中含有H-O键,O原子上含有孤电子对;
④N2 中含有N≡N键,N原子上含有孤电子对;
⑤H3O+ 中含有H-O键,O原子上有孤电子对;
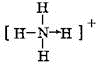
⑥NH4+ 中含有H-N键,N原子上没有孤电子对;
⑦CO2 中含有C=O键,O原子上含有孤电子对;
⑧H2O2中含有O-H键和O-O键,O原子上含有孤电子对;
(1)既有极性键又有非极性键的是①⑧,故答案为:①⑧;
(2)既有σ键又有π键的是④⑦,故答案为:④⑦;
(3)微粒中不含孤电子对的是⑥,故答案为:⑥;
(4)立体构型呈正四面体的是②⑥,故答案为:②⑥;
(5)水合氢离子中O原子还含有一个孤电子对,其电子式为: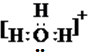 ;双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为:
;双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,
,
故答案为: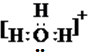 ;
; ;
;
(6)NH4+结构中氮原子和氢原子间的配位键是氮原子提供孤对电子,其结构式为 ;CO2中存在C=O键,其结构式为O=C=O,
;CO2中存在C=O键,其结构式为O=C=O,
故答案为: ;O=C=O.
;O=C=O.
点评 本题考查了共价键的判断、电子式、结构式等,根据物质的构成微粒及微粒间的作用力分析解答,题目难度不大.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 品红溶液 | B. | 浓硝酸 | C. | 碘水、淀粉溶液 | D. | 以上都能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
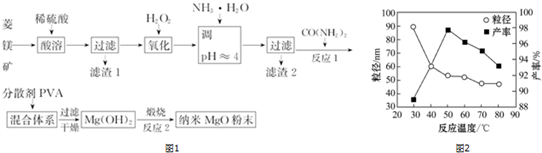
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在40 min内的平均速率可表示为 ν(NH3)=0.001 mol/L•min | |
| B. | 该反应达到平衡时,保持其他条件不变,容器中NH3、N2、H2的物质的量保持相等 | |
| C. | 其他条件不变,升高温度,可使该反应的速率加快 | |
| D. | 达到平衡时,ν(NH3)=ν(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
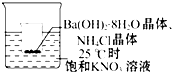 把小烧杯放入25℃的盛有饱和硝酸钾溶液的大烧杯中,小烧杯(已被设法固定)中放有 25g研成粉末的氢氧化钡晶体[Ba(OH)2•8H2O],再加入约12g的氯化铵晶体,并搅拌使其充分反应.
把小烧杯放入25℃的盛有饱和硝酸钾溶液的大烧杯中,小烧杯(已被设法固定)中放有 25g研成粉末的氢氧化钡晶体[Ba(OH)2•8H2O],再加入约12g的氯化铵晶体,并搅拌使其充分反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气在光照条件下发生加成反应 | |
| B. | 甲烷和乙烯都可以与氯气反应,反应类型不同 | |
| C. | 蔗糖、油脂、蛋白质都可以水解 | |
| D. | 乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2 2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- | |
| D. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
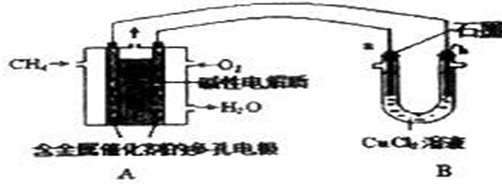
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com