
分析 盐酸是一元强酸、硫酸是二元强酸,醋酸是一元弱酸,
(1)若物质的量浓度均为0.1mol•L-1,a、b、c中c(H+)大小顺序是b>a>c,c(H+)越大溶液的pH越小;
(2)若三种酸的pH相同,说明三种酸中c(H+)相同,酸的电离程度越大、酸的元数越大,酸的浓度越小;
(3)在同体积、同浓度的三种酸中,三种酸的物质的量相同,分别加入等浓度的NaOH溶液,消耗NaOH溶液体积与酸最终电离出的n(H+)成正比;
(4)同体积、同pH的三种酸中,最终电离出的n(H+)大小顺序是c>a=b,分别加入等浓度的NaOH溶液,则恰好中和时所消耗的NaOH溶液的体积与最终电离出的n(H+)成正比;
(5)在同体积、同浓度的三种酸中,最终电离出的n(H+)大小顺序是b>a=c,分别加入足量的锌(Zn)充分反应后,在相同条件下产生H2的体积与最终电离出的n(H+)成正比;
(6)在同体积、同pH的三种酸中,最终电离出的n(H+)大小顺序是a=b<c,分别加入足量的锌(Zn)充分反应后,在相同条件下产生H2的体积与最终电离出的n(H+)成正比.
解答 解:盐酸是一元强酸、硫酸是二元强酸,醋酸是一元弱酸,
(1)若物质的量浓度均为0.1mol•L-1,a、b、c中c(H+)大小顺序是b>a>c,c(H+)越大溶液的pH越小,则溶液pH大小顺序是c>a>b,故答案为:c>a>b;
(2)若三种酸的pH相同,说明三种酸中c(H+)相同,酸的电离程度越大、酸的元数越大,酸的浓度越小,则三种酸的浓度大小顺序是c>a>b,故答案为:c>a>b;
(3)在同体积、同浓度的三种酸中,三种酸的物质的量相同,最终电离出的n(H+)大小顺序是b>a=c,分别加入等浓度的NaOH溶液,消耗NaOH溶液体积与酸最终电离出的n(H+)成正比,所以消耗NaOH溶液体积大小顺序是b>a=c,故答案为:b>a=c;
(4)同体积、同pH的三种酸中,最终电离出的n(H+)大小顺序是c>a=b,分别加入等浓度的NaOH溶液,则恰好中和时所消耗的NaOH溶液的体积与最终电离出的n(H+)成正比,则消耗NaOH溶液体积大小顺序是c>a=b,故答案为:c>a=b;
(5)在同体积、同浓度的三种酸中,最终电离出的n(H+)大小顺序是b>a=c,分别加入足量的锌(Zn)充分反应后,在相同条件下产生H2的体积与最终电离出的n(H+)成正比,则最终生成氢气体积大小顺序是b>a=c,
故答案为:b>a=c;
(6)在同体积、同pH的三种酸中,最终电离出的n(H+)大小顺序是a=b<c,分别加入足量的锌(Zn)充分反应后,在相同条件下产生H2的体积与最终电离出的n(H+)成正比,则生成氢气体积大小顺序是a=b<c,
故答案为:a=b<c.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生比较、分析、判断能力,明确弱酸溶液浓度与pH的关系是解本题关键,题目难点中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗的上层液体应由上口到出 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 锥形瓶用作反应容器时可以加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
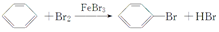 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com