
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1 盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法正确的是( )
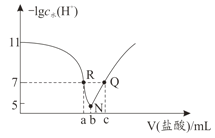
A.常温下,Kb(NH3·H2O)约为1×10-3
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积相等
【答案】B
【解析】
A.常温下,未加盐酸的氨水的-lgc水(H+)=11,则该溶液中水电离出的c(H+)=c(OH-)=10-11mol/L,溶液中c(OH-)=![]() mol/L=10-3mol/L,c(NH3H2O)≈0.1mol/L,Kb(NH3H2O)=
mol/L=10-3mol/L,c(NH3H2O)≈0.1mol/L,Kb(NH3H2O)=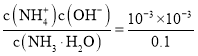 =1×10-5,A错误;
=1×10-5,A错误;
B.当-lgc水(H+)最小时,HCl与氨水恰好完全反应,所以b点NaOH溶液体积为20.00mL,B正确;
C. N点水电离出的H+浓度最大,溶液呈中性,R点碱过量,溶液呈碱性。Q点溶质为HCl和NH4Cl,溶液呈酸性,C错误;
D.R点氨水略过量,R→N加HCl消耗一水合氨,促进水的电离;N→Q加HCl,酸过量,抑制水的的电离,所以R到N、N到Q所加盐酸体积不相等,D错误;
故合理选项是B。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是
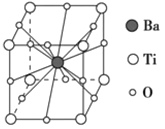
A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2![]() N2O4(正反应为放热反应) B. C(s)+CO2
N2O4(正反应为放热反应) B. C(s)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
C. N2+3H2![]() 2NH3(正反应为放热反应) D. H2S
2NH3(正反应为放热反应) D. H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)铁元素在周期表中的位置为_______。
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=_____。
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为_____。
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______。
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子是由Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生的H2为0.5mol;
⑥正极的电极反应式为Zn﹣2e﹣═Zn2+.

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,铝土矿![]() 含有
含有![]() 、FeO、
、FeO、![]() 、
、![]() 等物质
等物质![]() 用硫酸浸。下列说法中错误的是
用硫酸浸。下列说法中错误的是![]()
![]()
A.向浸出后的溶液加入过量NaOH溶液后存在:![]() 、
、![]() 、
、![]() 、
、![]()
B.向浸出后的溶液加入过量氨水后存在:![]() 、
、![]() 、
、![]() 、
、![]()
C.向浸出后的溶液通入过量HI后存在:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
D.若铝土矿改用NaOH溶液浸,浸出后的溶液中存在:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.1molNa与![]() 完全反应生成
完全反应生成![]() 和
和![]() 的混合物,转移电子
的混合物,转移电子![]() ,生成物中离子总数为
,生成物中离子总数为![]()
B.![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 数目为
数目为![]()
![]() 个
个
C.![]() 里含有的电子数目为
里含有的电子数目为![]()
D.62g白磷中含有P-P键的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子 PVA 可用于制滴眼露液,还可制成人工肾膜等医疗产品。由电石(CaC2)合成 PVA 的过程如下:
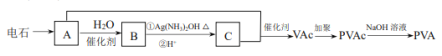
已知:VAc 的结构简式为 CH3COOCH=CH2 。
(1)电石制备 A 的化学方程式是_________________。
(2)B 与银氨溶液反应的化学方程式是_________________。
(3)PVA 的结构简式是__________________。
(4)聚乙烯醇肉桂酸酯的结构简式为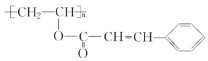 ,它是一种感光性高分子树脂。其单体可由 A 和肉桂酸(
,它是一种感光性高分子树脂。其单体可由 A 和肉桂酸( ![]() )合成,该反应的化学方程式是________________________________。
)合成,该反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析不正确的是( )
A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-![]() Fe(SCN)3正向移动
Fe(SCN)3正向移动
B.实验③中有Fe(OH)3生成
C.实验③和④中溶液颜色变浅的原因相同
D.实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com