
【题目】实验:①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析不正确的是( )
A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-![]() Fe(SCN)3正向移动
Fe(SCN)3正向移动
B.实验③中有Fe(OH)3生成
C.实验③和④中溶液颜色变浅的原因相同
D.实验②、③、④均可说明浓度改变对平衡移动的影响
【答案】C
【解析】
A.实验②向b中滴加3滴饱和FeCl3溶液,增大了Fe3+浓度使平衡Fe3++3SCN-Fe(SCN)3向正向移动,溶液颜色加深,A正确;
B.实验③中向上述b溶液中滴加3滴1molL1NaOH溶液,发生反应:Fe3++3OH=Fe(OH)3↓,铁离子浓度减小,平衡Fe3++3SCN-Fe(SCN)3逆向移动,溶液颜色变浅且出现浑浊,B正确;
C.实验③颜色变浅的原因是减少了铁离子浓度,平衡逆向移动,实验④最后颜色变浅是因为加入的硫氰化钾溶液过多,对体系进行了稀释,颜色变浅,两者原因不相同,C错误;
D.实验②③④都是在改变平衡体系中某种物质的浓度,溶液的颜色变化都说明了浓度改变对平衡移动的影响,D正确;
答案选C。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1氨水中滴入0.1mol·L-1 盐酸,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加盐酸体积的关系如图所示,下列说法正确的是( )
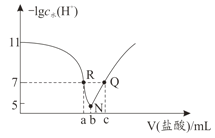
A.常温下,Kb(NH3·H2O)约为1×10-3
B.b=20.00
C.R、Q两点对应溶液均呈中性
D.R到N、N到Q所加盐酸体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)![]() 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3A(g)+B(g)![]() 2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.9 mol·L-1·min-1B.v(B)=0.2mol·L-1·min-1
C.v(C)=0.5mol·L-1·min-1D.v(D)=1.0mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液![]() 含有
含有![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() 中回收碘,操作过程如下:
中回收碘,操作过程如下:

![]() 向废液中加入
向废液中加入![]() 溶液,发生“还原”反应的离子方程式为 ______。
溶液,发生“还原”反应的离子方程式为 ______。
![]() “氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入
“氧化”操作在三颈烧瓶中进行,将溶液用盐酸调至pH约为2,缓慢通入![]() 。实验用水浴控制在
。实验用水浴控制在![]() 左右的较低温度下进行的原因是 ______。
左右的较低温度下进行的原因是 ______。

![]() 某研究小组用图装置对
某研究小组用图装置对![]() 与KI溶液的反应进行探究,发现通入
与KI溶液的反应进行探究,发现通入![]() 一段时间后,KI溶液变为黄色,继续通入
一段时间后,KI溶液变为黄色,继续通入![]() ,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:
,则溶液黄色变浅,最后变为无色.研究小组对所得无色溶液中碘元素的存在形态提出了以下假设:

假设一:没有![]() 形态;假设二:没有
形态;假设二:没有![]() 形态;假设三:有
形态;假设三:有![]() 形态。
形态。
![]() 请设计实验证明假设一成立
请设计实验证明假设一成立![]() 试剂自选
试剂自选![]() 。
。
实验操作 | 预期现象 | 结论 |
_______ | _______ | 假设一成立 |
![]() 若假设三成立,请写出生成
若假设三成立,请写出生成![]() 的离子方程式 ______。
的离子方程式 ______。
![]() 该研究小组还进行了对加碘盐中
该研究小组还进行了对加碘盐中![]() 含量测定的如下实验:
含量测定的如下实验:
![]() 准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成
准确称取加碘盐mg于烧杯中,加入适量蒸馏水和过量的KI,再滴入适量的稀硫酸,充分反应,将所得混合液配成![]() 待测溶液.移取
待测溶液.移取![]() 待测溶液于锥形瓶中,加几滴淀粉试液,用c
待测溶液于锥形瓶中,加几滴淀粉试液,用c![]()
![]() 标准液滴定至终点,重复3次,测得平均值为VmL。
标准液滴定至终点,重复3次,测得平均值为VmL。
已知:![]() ,
,![]() 。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含
。测定时,判断达到滴定终点的现象为 ______ ,由测定数据可求得该样品中含![]() 的质量分数为 ______
的质量分数为 ______ ![]() 用含m、c、V的代数式表示,
用含m、c、V的代数式表示,![]()
![]() 。
。
![]() 在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
在滴定操作正确无误的情况下,用此种测定方法测得的结果往往偏高,其原因是受空气的影响,请用离子方程式表示产生这一影响的原因 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() Fe全部溶于200mL一定浓度的硝酸溶液中,得到标准状况下的气体
Fe全部溶于200mL一定浓度的硝酸溶液中,得到标准状况下的气体![]() ,又测得反应后溶液中
,又测得反应后溶液中![]() 的浓度为
的浓度为![]() 设反应前后溶液体积的变化忽略不计
设反应前后溶液体积的变化忽略不计![]() 。下列说法不正确的是
。下列说法不正确的是![]()
A.![]() 气体是NO
气体是NO
B.反应后Fe全部转化为![]()
C.反应后的溶液中![]()
D.反应后的溶液最多还能再溶解![]() Fe
Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烷烃![]() 与烯烃
与烯烃![]() 的混合气体
的混合气体![]() ,其密度为同状况下
,其密度为同状况下![]() 密度的11.2倍,将混合气体通过足量的溴水,溴水增重
密度的11.2倍,将混合气体通过足量的溴水,溴水增重![]() ,回答下列问题:
,回答下列问题:
(1)写出结构简式:![]() ________,
________,![]() ________。
________。
(2)![]() 与丁烯互为________(填“同分异构体”或“同系物”)。
与丁烯互为________(填“同分异构体”或“同系物”)。
(3)写出![]() 与溴水反应的化学方程式:________________。
与溴水反应的化学方程式:________________。
(4)下列有关![]() 的结构或性质的说法正确的是________(填序号)。
的结构或性质的说法正确的是________(填序号)。
A 不能使酸性高锰酸钾溶液褪色,但能使溴的四氯化碳溶液褪色
B 分子中所有原子都在同一平面上
C 分子中有7个单键
D 与![]() 在一定条件下能加成并只得到一种产物
在一定条件下能加成并只得到一种产物
Ⅱ.(5)已知甲苯(![]() )能使酸性
)能使酸性![]() 溶液褪色。某有机物的结构简式为
溶液褪色。某有机物的结构简式为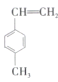 ,下列说法正确的是________(填序号)。
,下列说法正确的是________(填序号)。
A 该有机物使溴水褪色和在催化剂作用下与液溴反应原理一样
B 能用酸性![]() 溶液判断分子中存在碳碳双键
溶液判断分子中存在碳碳双键
C 该有机物在一定条件下与浓硝酸发生反应生成的苯环上的一硝基取代物可能有3种
D ![]() 该有机物在一定条件下最多与
该有机物在一定条件下最多与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期元素性质的递变规律,设计了如下实验。
(1)将等质量的钠、镁、铝分别投入到足量的相同浓度的盐酸中,试预测实验结果:上述金属中___(填化学式,下同)与盐酸反应最剧烈,___与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊现象,可证明S、Cl元素非金属性强弱顺序为___,反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com