
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.1molNa与![]() 完全反应生成
完全反应生成![]() 和
和![]() 的混合物,转移电子
的混合物,转移电子![]() ,生成物中离子总数为
,生成物中离子总数为![]()
B.![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 数目为
数目为![]()
![]() 个
个
C.![]() 里含有的电子数目为
里含有的电子数目为![]()
D.62g白磷中含有P-P键的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是

A.图2中的A为分液漏斗
B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
C.图1实验可通过观察产生气泡的快慢来比较反应速率
D.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析不正确的是( )
A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-![]() Fe(SCN)3正向移动
Fe(SCN)3正向移动
B.实验③中有Fe(OH)3生成
C.实验③和④中溶液颜色变浅的原因相同
D.实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用下图所示装置制备乙酸乙酯。实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入石蕊溶液1毫升,发现石蕊溶液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管)。下列有关该实验的描述不正确的是( )
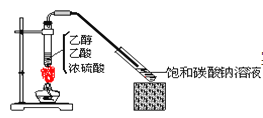
A.制备的乙酸乙酯中混有乙酸和乙醇杂质
B.该实验中浓硫酸的作用是催化和吸水
C.饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇和乙酸
D.石蕊层为三层,由上而下是蓝、紫、红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学习过氧化钠与水的反应时,向滴有酚酞的水中加入过氧化钠,发现溶液先变红后褪色,对此产生兴趣并进行研究。
(1)写出Na2O2与水反应的化学方程式:______。
(2)甲同学查阅资料:红色褪去的原因是H2O2在碱性条件下氧化了酚酞。
①甲同学通过实验证实了Na2O2与水反应所得溶液中有较多的H2O2:取少量反应所得溶液,加入试剂______(填化学式),有气体产生。
②甲同学利用3% H2O2溶液、酚酞试液、1mol·L-1 NaOH溶液,证实了碱性条件是必需的。
操作 | 现象 | |
实验1 | 向2mL 3%H2O2溶液中加入3滴酚酞试液,振荡,静置5min,再加入5滴1mol·L-1 NaOH溶液 | 观察到______。 |
(3)为了更深入地了解该原理,甲同学继续查阅资料,发现H2O2溶液中相关微粒的物质的量分数X(i)与溶液pH的关系如图所示。
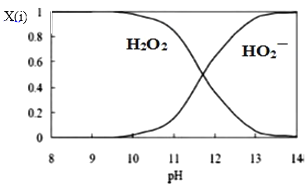
据此,甲同学设计实验2继续研究:
操作 | 现象 | |
实验2 | i.配制20mL 3%H2O2与NaOH的混合溶液,调节pH分别为10~14。 ii.滴入3滴酚酞试液,搅拌后静置,记录酚酞完全褪色的时间 | 得到如图所示实验结果:
|
甲同学由此提出假设I:溶液褪色的主要原因是酚酞被HO![]() 氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
(4)乙同学查阅资料,发现酚酞(以H2L表示)在不同pH条件下存在多种结构之间的变化:
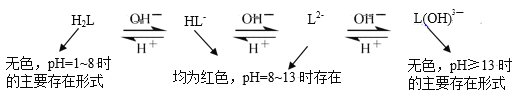
由此提出,甲同学实验2中pH13时红色褪去的原因还存在假设II:_____。
(5)针对假设I、II,小组同学设计了如下实验:
试剂加入顺序 | 现象 | |
实验3 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入3滴酚酞试液 | 溶液变红,然后褪色 |
iii.搅拌、静置后加入2mL 30% H2O2溶液 | _____ | |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 溶液变红,然后褪色 | |
实验4 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入2mL 30% H2O2溶液 iii.搅拌、静置后加入3滴酚酞试液 | 溶液变红,然后褪色 |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 不变红 |
①与L2-和HL-相比较,L(OH)![]() 比前两者更_____被氧化(填“难”或“易”)。
比前两者更_____被氧化(填“难”或“易”)。
②实验3中调节pH至12,溶液变红然后褪色的原因是:_____。
③根据实验得出结论:甲同学实验2中pH13时红色褪去的主要原因是_____(填“假设I”或“假设II”),请依据实验现象阐述理由:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是 ( )
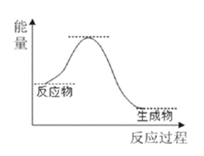

A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4 溶液显酸性,关于 NaHC2O4 溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4)
)+c(H2C2O4)
C.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.c(H+)+c(H2C2O4)=c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整可以得到合成气(CO和H2),有利于减小温室效应,其主要反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol1,同时存在以下反应:积碳反应:CH4(g)C(s)+2H2(g) ΔH=+75 kJ·mol1,消碳反应:CO2(g)+C(s)2CO(g) ΔH=+172 kJ·mol1,积碳会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图。下列说法正确的是

A.高压利于提高 CH4 的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.升高温度,积碳反应的化学平衡常数K减小,消碳反应的K增大
D.温度高于600℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快, 积碳量减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com