
【题目】NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是 ( )
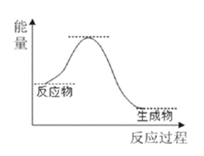

A.NH3催化还原NO为吸热反应
B.过程Ⅰ中NH3断裂非极性键
C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂
D.脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g) ![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
科目:高中化学 来源: 题型:
【题目】![]() (次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等.一种利用泥磷(含
(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等.一种利用泥磷(含![]() 和少量
和少量![]() 、
、![]() 、
、![]() 、
、![]() 等)为原料制备
等)为原料制备![]() 的工艺流程如下:
的工艺流程如下:
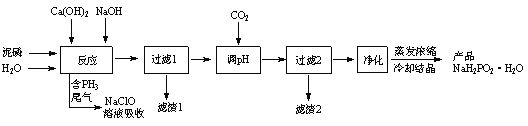
已知:①![]() 与两种碱的反应主要有:
与两种碱的反应主要有:
I.![]()
II.![]()
III.![]()
②2.实验温度下,![]()
![]()
(1)已知![]() 是一元中强酸,写出
是一元中强酸,写出![]() 溶液中存在的所有平衡方程式:_________。
溶液中存在的所有平衡方程式:_________。
(2)通![]() “调
“调![]() ”时,写出除去溶液中
”时,写出除去溶液中![]() 杂质的离子方程式是_________。
杂质的离子方程式是_________。
(3)“过滤2”的滤渣2主要成分为_________(填化学式),“净化”除去![]() 及
及![]() 等时还须用到
等时还须用到![]() 、
、![]() 及
及![]() 溶液,当加入一定量的
溶液,当加入一定量的![]() 溶液后,静置,溶液中
溶液后,静置,溶液中![]() ,则此时溶液中
,则此时溶液中![]() 的浓度为_________
的浓度为_________![]() 。
。
(4)尾气中的![]() 被
被![]() 溶液吸收生成
溶液吸收生成![]() ,则该吸收反应中氧化产物与还原产物的物质的量之比为_________。从吸收液中经结晶、过滤、洗涤、干燥,也可获得产品
,则该吸收反应中氧化产物与还原产物的物质的量之比为_________。从吸收液中经结晶、过滤、洗涤、干燥,也可获得产品![]() ,洗涤该产品常用乙醇,其原因是_________。
,洗涤该产品常用乙醇,其原因是_________。
(5)次磷酸钠的磷元素易被强氧化剂氧化成最高价。实验室可用滴定法测定产品纯度。
甲同学准确称取![]() 产品配成
产品配成![]() 溶液准确量取
溶液准确量取![]() 溶液于锥形瓶中,用
溶液于锥形瓶中,用![]() 酸性
酸性![]() 标准溶液经规范、严密的多次平行滴定,平均消耗酸性
标准溶液经规范、严密的多次平行滴定,平均消耗酸性![]() 溶液
溶液![]() ,则测得产品的纯度为_________,乙同学认为甲同学的测定结果不科学,分析导致甲同学得出如此测定结果的最可能原因是_________。
,则测得产品的纯度为_________,乙同学认为甲同学的测定结果不科学,分析导致甲同学得出如此测定结果的最可能原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
均为短周期元素,A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子序数:A>B;②原子半径:A<B;③离子半径:A>B;④原子最外层电子数:A≤B,其中正确的是( )
A.①②B.①④C.②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量稀硫酸(不考虑反应过程中硫酸浓度的变化)中加入一定量的锌粒,同时不断向其中滴加硫酸铜溶液,观察到生成氢气的速率如图所示。下列有关说法错误的是( )
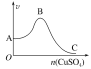
A.AB段速率的变化可能是因为溶液温度逐渐升高
B.AB段速率的变化可能是因为形成了铜锌原电池
C.BC段速率的变化可能是因为溶液温度逐渐降低
D.BC段速率变化的原因主要是置换出的铜太多,覆盖在锌粒表面,阻碍了反应的进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是

A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是( )
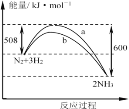
A.正反应的活化能等于逆反应的活化能
B.a曲线是加入催化剂时的能量变化曲线
C.1moN2与3moH2充分反应放出的热量小于92kJ
D.增大压强,可以提高反应物活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
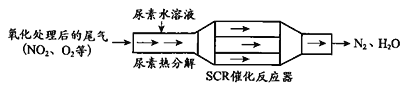
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,请写出CO2的电子式___________________。
②反应器内NH3还原NO2过程中,若还原产物比氧化产物少1mol,转移电子总数__________个(用NA表示)。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成_______________________________________________。
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________
(2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。
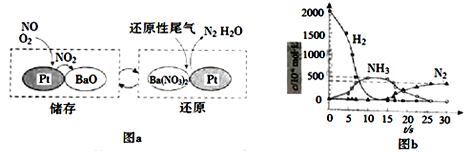
① 通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_________。
② 用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。
③ 还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:________________________ ______15NNO+ ________H2O
______15NNO+ ________H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.01mol的四氧化二氮气体充入0.1L的密闭容器中,发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | 0.070 | 0.050 | c3 | a | b |
c(NO2) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
请填空:
(1)该反应的化学方程式为____________。达到平衡时N2O4的转化率为____________,表中c2____________c3;a____________b(填“>”“<”或“=”)。
(2)在0~20s内,N2O4的平均反应速率为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com