
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
【答案】最外层电子数 电子层数 电子层数 最外层电子数 8 Ne Ar Mg 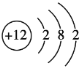
【解析】
(1)核电荷数为6和14的元素原子,原子结构示意图分别为![]() 、
、![]() ,它们的最外层电子数相同,电子层数不相同;核电荷数为15和16的元素原子,原子结构示意图分别为
,它们的最外层电子数相同,电子层数不相同;核电荷数为15和16的元素原子,原子结构示意图分别为![]() 、
、![]() ,它们的电子层数相同,最外层电子数不相同;核电荷数为10和18的元素原子,它们的原子结构示意图
,它们的电子层数相同,最外层电子数不相同;核电荷数为10和18的元素原子,它们的原子结构示意图![]() 、
、![]() ,最外层电子数均为8,它们的元素符号分别是Ne、Ar。答案为:最外层电子数;电子层数;电子层数;最外层电子数;8;Ne;Ar;
,最外层电子数均为8,它们的元素符号分别是Ne、Ar。答案为:最外层电子数;电子层数;电子层数;最外层电子数;8;Ne;Ar;
(2)根据原子核外有三个电子层,可知该元素的核电荷数大于等于11,小于等于18。设该元素原子的核外电子数为![]() ,则
,则![]() ,由
,由![]() 为整数可知,
为整数可知,![]() 或18(排除),核电荷数为12的元素是镁,
或18(排除),核电荷数为12的元素是镁,![]() 的原子结构示意图为
的原子结构示意图为![]() 。答案为:
。答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知 2NO(g)+O2(g)2NO2(g) H<0,若该反应在绝热、恒容的密闭体系中进行,则下列示意图能说明在t1时刻达到平衡状态的是 ( )
a. 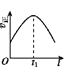 b.
b.  c.
c. 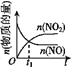 d.
d. 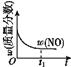
A.abB.bcC.bdD.cd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐是一种重要的化工原料,化学组成可表示为x(NH4)2SO4yFeSO4zH2O。
为确定摩尔盐的组成,进行如下实验:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取25.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体2.330g。
步骤三:另取25.00mL溶液A,加入0.05000molL-1KMnO4酸性溶液,发生反应:Fe2++MnO4-+H+→Fe3++Mn2++H2O(未配平),当两者恰好完全反应时,消耗KMnO4溶液的体积为20.00mL。
(1)步骤一中,必须使用到的玻璃仪器有玻璃棒、胶头滴管、烧杯和___。
(2)检验溶液A中含有NH4+的实验方法是___。
(3)步骤二中,证明所加BaCl2溶液己经过量的实验方法为___。
(4)通过计算确定摩尔盐中x:y的值___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述能说明氯元素原子得电子能力比硫元素原子强的是( )
①![]() 的溶解度比
的溶解度比![]() 大 ②
大 ②![]() 的酸性比氢硫酸强 ③
的酸性比氢硫酸强 ③![]() 的稳定性比
的稳定性比![]() 强 ④
强 ④![]() 的还原性比
的还原性比![]() 强 ⑤
强 ⑤![]() 的酸性比
的酸性比![]() 强 ⑥
强 ⑥![]() 与铁反应生成
与铁反应生成![]() ,而
,而![]() 与铁反应生成
与铁反应生成![]() ⑦
⑦![]() 能与
能与![]() 反应生成
反应生成![]() ⑧在元素周期表中
⑧在元素周期表中![]() 处于
处于![]() 同周期的右侧 ⑨还原性:
同周期的右侧 ⑨还原性:![]()
A.③④⑤⑦⑧⑨B.③④⑥⑦⑧
C.③⑥⑦⑧⑨D.①②③④⑤⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是___________,其外围电子排布式为___________。
(2)已知第四电离能大小:I4(Fe)> I4 (Co),从原子结构的角度分析可能的原因是___________。
(3)配位化学创始人维尔纳发现,取1mol配合物CoCl3·6NH3(黄色)溶于水,加人足量硝酸银溶液,产生3mol白色沉淀,沉淀不溶于稀硝酸。原配合物中络离子形状为正八面体。
①根据上述事实推测原配合物中络离子化学式为___________。
②该配合物在热NaOH溶液中发生反应,并释放出气体,该反应的化学方程式___________;生成气体分子的中心原子杂化方式为___________。
(4)经X射线衍射测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于___________,若该堆积方式下的晶胞参数为acm,则钴原子的半径为___________pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>____________。基态K+电子占据最高能级的电子云轮廓图为________形。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是_______,中心原子的杂化形式为_______。NaBH4中存在_____(填标号)。
a. 离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为________,其中Be的配位数为_______。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:_____________________。
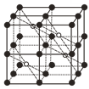
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,其空隙率是________。若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=_________ g·cm-3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1)
2NH3(g) ΔH=-92.4kJ·mol-1)

下列说法正确的是( )
A.2c1>c3B.a+b=92.4C.2p1<p3D.α1+α3>1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com