
【题目】摩尔盐是一种重要的化工原料,化学组成可表示为x(NH4)2SO4yFeSO4zH2O。
为确定摩尔盐的组成,进行如下实验:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取25.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体2.330g。
步骤三:另取25.00mL溶液A,加入0.05000molL-1KMnO4酸性溶液,发生反应:Fe2++MnO4-+H+→Fe3++Mn2++H2O(未配平),当两者恰好完全反应时,消耗KMnO4溶液的体积为20.00mL。
(1)步骤一中,必须使用到的玻璃仪器有玻璃棒、胶头滴管、烧杯和___。
(2)检验溶液A中含有NH4+的实验方法是___。
(3)步骤二中,证明所加BaCl2溶液己经过量的实验方法为___。
(4)通过计算确定摩尔盐中x:y的值___(写出计算过程)。
【答案】100mL容量瓶 取少量溶液A,加入氢氧化钠溶液,加热,产生的气体若能使湿润红色石蕊试纸变蓝,则说明溶液中含有铵根离子 取上层清液,继续滴加氯化钡溶液,若不出现白色沉淀,则说明氯化钡已加过量 1:1
【解析】
⑴配制溶液应该用100mL的容量瓶进行配制;
⑵检验铵根时要先加氢氧化钠溶液,再加热;
⑶验证加入物质是否过量,则向取上层清液中再继续加检验试剂,看是否有沉淀生成;
⑷先算出硫酸根的物质的量,再计算出亚铁离子的物质的量,再算x,最后得出比例关系。
⑴步骤一中,配制100mL溶液必须使用到的玻璃仪器有玻璃棒、胶头滴管、烧杯和100mL容量瓶;
⑵检验溶液A中含有NH4+的实验方法是取少量溶液A,加入氢氧化钠溶液,加热,产生的气体若能使湿润红色石蕊试纸变蓝,则说明溶液中含有铵根离子;
⑶步骤二中,证明所加BaCl2溶液己经过量,即证明溶液中是否含有SO42-,实验方法是取上层清液与试管,继续滴加BaCl2溶液,若不出现白色沉淀,则说明BaCl2已加过量;
⑷25mL溶液中生成了2.33g硫酸钡沉淀即物质的量![]() ,再根据关系式
,再根据关系式![]() ,n(Fe2+)=5n(MnO4-) = 5×0.05000molL-1×0.02L = 0.005mol,x + y =0.01mol,y=0.005mol,则x=0.005mol,因此x:y=1:1。
,n(Fe2+)=5n(MnO4-) = 5×0.05000molL-1×0.02L = 0.005mol,x + y =0.01mol,y=0.005mol,则x=0.005mol,因此x:y=1:1。


科目:高中化学 来源: 题型:
【题目】G是一种治疗急慢性呼吸道感染的特效药中间体,其制备路线如图:

(1)化合物C中的含氧官能团是_____。
(2)A→B的反应类型是______。
(3)化合物F的分子式为C14H21NO3,写出F的结构简式______。
(4)从整个制备路线可知,反应B→C的目的是______。
(5)同时满足下列条件的B的同分异构体共有_______种。
①分子中含有苯环,能与NaHCO3溶液反应;
②能使FeCl3溶液显紫色
(6)根据已有知识并结合相关信息,完成以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
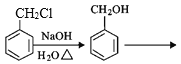
 ,其中第二步反应的方程式为_____。
,其中第二步反应的方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如表所示.
原子或分子相关信息 | 单质或化合物相关信息 | |
X |
| X的最高价氧化物对应的水化物为无机酸中的最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有 |
(1)W在周期表中的位置为______,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________
(3)Z的氧化物在通讯领域用来作______,工业上制备Z的单质的化学反应方程式为______。锗与Z是同一主族元素,它可用来制造半导体品体管.研究表明:有机锗具有明显的抗肿瘤活性,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为_______
溶液反应生成锗酸盐,反应的化学方程式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为A12O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为__。
(2)“滤渣Ⅰ”的成分有___。
(3)向“过滤Ⅰ”所得滤液中通入足量的CO2,反应的离子方程式为___。
(4)“滤液Ⅱ”中加入足量的CaO,生成的__(填化学式)可循环利用。
(5)“灼烧”的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁的用途较为广泛。工业上用废铁屑制备氧化铁的流程如图:
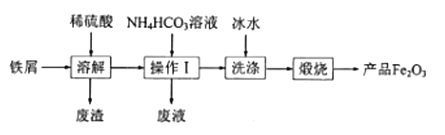
(1)“溶解”时主要反应的离子方程式为___。
(2)操作Ⅰ的名称是___。
(3)加入 NH4HCO3溶液生成FeCO3沉淀和CO2,则“废液”中含有的主要离子有___。
(4)在空气中煅烧FeCO3可得产品Fe2O3,写出该反应的化学方程式:___。实际生产时,产品Fe2O3中常混有FeO。为了减少FeO,“煅烧”时可以采取的措施有___(写一条)。
(5)产品Fe2O3与A粉的混合物称为铝热剂,可用于焊接铁轨。该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层电子数从1到8(第1周期元素及过渡元素除外)重复出现
B.随着元素原子序数的递增,元素最高正化合价从+1到+7、负化合价从-7到-1重复出现
C.随着元素原子序数的递增,原子(稀有气体元素原子除外)半径从小到大发生周期性变化
D.元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,其原子半径的大小顺序为X>Y>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的反应,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列判断错误的是( )
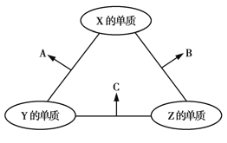
A.X的最外层电子数为6
B.A和C之间不可能发生氧化还原反应
C.B的沸点高于C的沸点
D.A不能溶于B中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法中正确的是( )
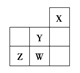
A. Y的原子半径在同周期主族元素中最大
B. W的非金属性比Z的弱
C. Z的气态氢化物的稳定性在同主族元素中最强
D. W的最高价氧化物对应的水化物是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com