
【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如表所示.
原子或分子相关信息 | 单质或化合物相关信息 | |
X |
| X的最高价氧化物对应的水化物为无机酸中的最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有 |
(1)W在周期表中的位置为______,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________
(3)Z的氧化物在通讯领域用来作______,工业上制备Z的单质的化学反应方程式为______。锗与Z是同一主族元素,它可用来制造半导体品体管.研究表明:有机锗具有明显的抗肿瘤活性,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为_______
溶液反应生成锗酸盐,反应的化学方程式为_______
【答案】第四周期Ⅷ族 4Fe(OH)2+O2+2H2O=4Fe(OH)3 ![]() Al2O3+6H+=2Al3++3H2O 光导纤维 SiO2+2C
Al2O3+6H+=2Al3++3H2O 光导纤维 SiO2+2C![]() Si+2CO↑
Si+2CO↑ ![]()
【解析】
X、Y、Z为短周期元素,X的最高价氧化物对应的水化物为无机酸中的最强酸,则X为Cl;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,Y原子的最外层电子数等于电子层数,则Y为Al;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,原子的最外层电子数是次外层电子数的![]() ,则Z为Si;W原子的最外层电子数小于4,常见化合价有
,则Z为Si;W原子的最外层电子数小于4,常见化合价有![]() 、
、![]() ,
,![]() 的稀溶液呈黄色,则W为Fe。
的稀溶液呈黄色,则W为Fe。
(1)W为Fe,在周期表中的位置为第四周期Ⅷ族,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。答案为:第四周期Ⅷ族;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。答案为:第四周期Ⅷ族;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)X的简单阴离子为![]() ,结构示意图为
,结构示意图为![]() ,X的最高价氧化物对应的水化物为高氯酸,Y的氧化物为氧化铝,二者反应的离子方程式为Al2O3+6H+=2Al3++3H2O。答案为:
,X的最高价氧化物对应的水化物为高氯酸,Y的氧化物为氧化铝,二者反应的离子方程式为Al2O3+6H+=2Al3++3H2O。答案为:![]() ;Al2O3+6H+=2Al3++3H2O;
;Al2O3+6H+=2Al3++3H2O;
(3)Z的氧化物为二氧化硅,在通讯领域用来作光导纤维,工业上制备硅单质的化学反应方程式为SiO2+2C![]() Si+2CO↑,锗不与
Si+2CO↑,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为
溶液反应生成锗酸盐,反应的化学方程式为![]() 。答案为:光导纤维;SiO2+2C
。答案为:光导纤维;SiO2+2C![]() Si+2CO↑;
Si+2CO↑;![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出符合下列条件的原子的元素符号并画出其原子结构示意图。
①核外有2个电子层、10个电子的原子__________________;
②质量数为23、中子数为12的原子__________________;
③电子总数是最外层电子数3倍的原子__________________。
(2)用下列原子或离子的结构示意图的编号(A、B、C、D)填空:
A.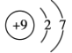 B.
B.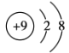 C.
C.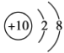 D.
D.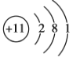
①电子层排布相同的是__________________;
②属于同一种元素的是__________________;
③属于金属元素的是__________________;
④属于稀有气体元素的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2NO(g)+O2(g)2NO2(g) H<0,若该反应在绝热、恒容的密闭体系中进行,则下列示意图能说明在t1时刻达到平衡状态的是 ( )
a. 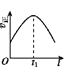 b.
b.  c.
c. 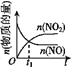 d.
d. 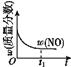
A.abB.bcC.bdD.cd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漆酚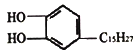 是生漆的主要成分,能溶于有机溶剂中,生漆涂在物体表面,能在空气中干燥转变为黑色漆膜从而起到保护层的作用,下列说法错误的是
是生漆的主要成分,能溶于有机溶剂中,生漆涂在物体表面,能在空气中干燥转变为黑色漆膜从而起到保护层的作用,下列说法错误的是
A. 可以燃烧,当氧气充分时,产物为CO2和H2O
B. 与FeCl3溶液发生显色反应
C. 能发生取代反应和加成反应
D. 不能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、M是原子序数依次增大的五种短周期主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与 X 是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是_______________。
(2)WX2的电子式是________________。
(3)R2X、R2Y中,稳定性较高的是___________(填化学式),请从原子结构的角度解释其原因:_____________________。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是___________填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国拥有丰富的稀土矿产资源,在合金中加入适量的稀土金属,能大大改善合金的性能,因而,稀土金属又被称为冶金工业的维生素。铈是一种重要的稀土元素,常见的化合价为+3和+4。某课题小组以平板电视显示屏生产过程中,产生的大量废玻璃粉末为原料(其中含有SiO2、Fe2O3、CeO2、FeO等物质),制取CeO2和硫酸铁铵矾[NH4Fe(SO4)212H2O],流程如下:
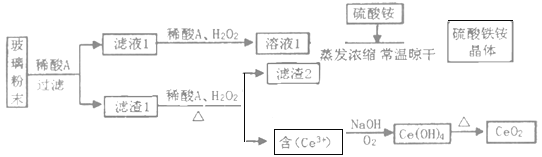
已知:CeO2不溶于强酸或强碱
(1)稀酸A中酸的分子式是___。滤渣2的主要成分___。(填化学式)
(2)滤液1中加入H2O2溶液的目的是___。滤渣1中加入H2O2,主要利用了H2O2的什么性质?___。
(3)酸性条件下,H2O2、Fe3+、CeO2三种物质,氧化性由强到弱的顺序是___。
(4)写出由滤液2生成Ce(OH)4的离子方程式___。
(5)硫酸铁铵矾[NH4Fe(SO4)212H2O]广泛用于水的净化处理,其净水原理是___(用离子方程式表示)。
(6)取上述流程中所获得的Ce(OH)4样品5.31g,加稀H2SO4溶解后配制成100mL溶液,取出10.00mL,用浓度为0.1000 molL-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该样品中Ce(OH)4的纯度是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐是一种重要的化工原料,化学组成可表示为x(NH4)2SO4yFeSO4zH2O。
为确定摩尔盐的组成,进行如下实验:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取25.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体2.330g。
步骤三:另取25.00mL溶液A,加入0.05000molL-1KMnO4酸性溶液,发生反应:Fe2++MnO4-+H+→Fe3++Mn2++H2O(未配平),当两者恰好完全反应时,消耗KMnO4溶液的体积为20.00mL。
(1)步骤一中,必须使用到的玻璃仪器有玻璃棒、胶头滴管、烧杯和___。
(2)检验溶液A中含有NH4+的实验方法是___。
(3)步骤二中,证明所加BaCl2溶液己经过量的实验方法为___。
(4)通过计算确定摩尔盐中x:y的值___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com